本发明公开了一种基于干酪乳酸杆菌分泌物制备纳米氧化锌的方法,用于解决现有方法制备的纳米氧化锌纯度低的技术问题。技术方案是利用无水乙酸锌为底物,利用干酪乳酸杆菌L.casei ATCC 393为生物媒介,制备出中间产物Zn(OH),中间产物Zn(OH)恒温磁力搅拌后,再经过高温煅烧,得到纳米ZnO。与背景技术相比,无水乙酸锌相较于ZnCl毒性低;干酪乳酸杆菌L.casei ATCC 393相较于唾液乳酸杆菌L3更为安全;在纳米ZnO的制备中过程中是基于L.casei ATCC 393的发酵产物而不是菌体本身,这样简化了分离、纯化过程,制备得到的产物纳米ZnO的产率和纯度更高。
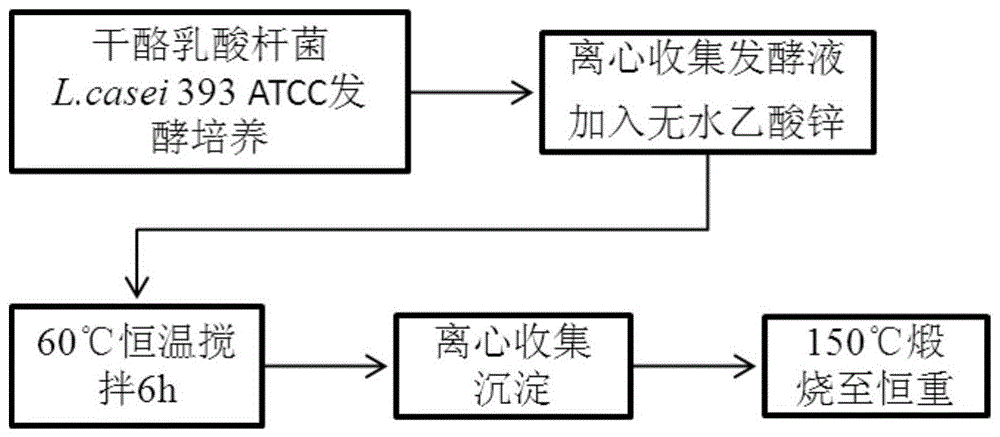
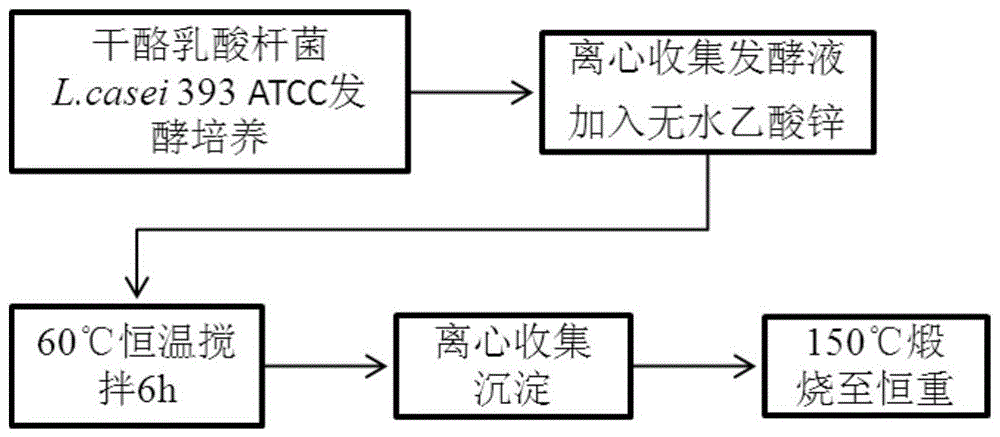
1.一种基于干酪乳酸杆菌分泌物制备纳米氧化锌的方法,其特征在于包括以下步骤:步骤一、菌株活化:用MRS固体培养基对干酪乳酸杆菌L.casei ATCC 393菌株进行活化培养,MRS固体培养基配方如下:蛋白胨10~12g/L,牛肉膏10~12g/L,酵母膏4~6g/L,柠檬酸氢二铵1.5~2.5g/L,葡萄糖20~25g/L,结晶乙酸钠4~6g/L,磷酸氢二钾2~2.5g/L,七水硫酸镁0.5~0.6g/L,一水硫酸锰0.25~0.3g/L,吐温80 1~1.5mL/L,琼脂15~20g/L,pH 6.2~6.6;将L.casei ATCC 393划线接种于MRS固体培养基,于35~38℃厌氧培养36~48h;步骤二、生物合成氢氧化锌:将挑取的干酪乳酸杆菌L.casei ATCC 393的单菌落用MRS液体培养基培养,MRS液体培养基配方如下:蛋白胨10~12g/L,牛肉膏10~12g/L,酵母膏4~6g/L,柠檬酸氢二铵1.5~2.5g/L,葡萄糖20~25g/L,结晶乙酸钠4~6g/L,磷酸氢二钾2~2.5g/L,七水硫酸镁0.5~0.6g/L,一水硫酸锰0.25~0.3g/L,吐温80 1~1.5mL/L,pH 6.2~6.6;于35~38℃静置培养36~48h后,收集发酵液,55~65℃恒温搅拌,在搅拌过程中加入终浓度0.15~0.2M乙酸锌,搅拌5~6h;步骤三、分离提取氢氧化锌并转化为纳米ZnO:收集搅拌后的溶液,于高速冷冻离心机,9900~11000rpm,4℃离心8~10min,弃上清,收集沉淀;将沉淀用无菌水洗涤三次,于高速冷冻离心机,9900~11000rpm,4℃离心8~10min,弃上清,收集沉淀;将沉淀冷冻干燥,使成分稳定;随后在马福炉中140~160℃煅烧8~12h,得到纳米ZnO颗粒。
技术领域
本发明涉及一种制备纳米氧化锌的方法,特别涉及一种基于干酪乳酸杆菌分泌物制备纳米氧化锌的方法。
背景技术
文献“唾液乳杆菌L3生物合成纳米氧化锌的工艺研究《现代食品科技》2013年第9期第2192-2198页”公开了一种纳米氧化锌的制备方法,该方法采用的生物媒介是从断奶仔猪粪便中分离的唾液乳酸杆菌L3,制备过程是待唾液乳酸杆菌L3发酵培养结束后,调节培养液的pH,加入适当浓度的ZnCl2溶液,水浴保温反应一定时间,置于37℃陈化12h,离心收集产物并洗涤三次,烘干至恒重,即为纳米ZnO。但是此生产工艺中所利用的ZnCl2有毒性和腐蚀性,并且所用的唾液乳酸杆菌L3不是目前国家公认的益生菌;制备过程中没有分离菌体,后期制备的纳米氧化锌纯度不高。
发明内容
为了克服现有方法制备的纳米氧化锌纯度低的不足,本发明提供一种基于干酪乳酸杆菌分泌物制备纳米氧化锌的方法。该方法利用无水乙酸锌为底物,利用干酪乳酸杆菌L.casei ATCC 393为生物媒介,制备出中间产物Zn(OH)2,中间产物Zn(OH)2恒温磁力搅拌后,再经过高温煅烧,得到纳米ZnO。与背景技术相比,无水乙酸锌相较于ZnCl2毒性低;干酪乳酸杆菌L.casei ATCC 393相较于唾液乳酸杆菌L3更为安全;在纳米ZnO的制备中过程中是基于L.casei ATCC 393的发酵产物而不是菌体本身,这样有利于简化后续的分离、纯化过程,而且制备得到的产物纳纳米ZnO的产率和纯度更高。
本发明解决其技术问题所采用的技术方案:一种基于干酪乳酸杆菌分泌物制备纳米氧化锌的方法,其特点是包括以下步骤:
步骤一、菌株活化:
用MRS固体培养基对干酪乳酸杆菌L.casei ATCC 393菌株进行活化培养,MRS固体培养基配方如下:蛋白胨10~12g/L,牛肉膏10~12g/L,酵母膏4~6g/L,柠檬酸氢二铵1.5~2.5g/L,葡萄糖20~25g/L,结晶乙酸钠4~6g/L,磷酸氢二钾2~2.5g/L,七水硫酸镁0.5~0.6g/L,一水硫酸锰0.25~0.3g/L,吐温80 1~1.5mL/L,琼脂15~20g/L,pH 6.2~6.6;将L.casei ATCC 393划线接种于MRS固体培养基,于35~38℃厌氧培养36~48h。
步骤二、生物合成氢氧化锌:
将挑取的干酪乳酸杆菌L.casei ATCC 393的单菌落用MRS液体培养基培养,MRS液体培养基配方如下:蛋白胨10~12g/L,牛肉膏10~12g/L,酵母膏4~6g/L,柠檬酸氢二铵1.5~2.5g/L,葡萄糖20~25g/L,结晶乙酸钠4~6g/L,磷酸氢二钾2~2.5g/L,七水硫酸镁0.5~0.6g/L,一水硫酸锰0.25~0.3g/L,吐温80 1~1.5mL/L,pH 6.2~6.6;于35~38℃静置培养36~48h后,收集发酵液,55~65℃恒温搅拌,在搅拌过程中加入终浓度0.15~0.2M乙酸锌,搅拌5~6h。
步骤三、分离提取氢氧化锌并转化为纳米ZnO:
收集搅拌后的溶液,于高速冷冻离心机,9900~11000rpm,4℃离心8~10min,弃上清,收集沉淀;将沉淀用无菌水洗涤三次,于高速冷冻离心机,9900~11000rpm,4℃离心8~10min,弃上清,收集沉淀;将沉淀冷冻干燥,使成分稳定;随后在马福炉中140~160℃煅烧8~12h,得到纳米ZnO颗粒。
本发明的有益效果是:该方法利用无水乙酸锌为底物,利用干酪乳酸杆菌L.caseiATCC 393为生物媒介,制备出中间产物Zn(OH)2,中间产物Zn(OH)2恒温磁力搅拌后,再经过高温煅烧,得到纳米ZnO。与背景技术相比,无水乙酸锌相较于ZnCl2毒性低;干酪乳酸杆菌L.casei ATCC 393相较于唾液乳酸杆菌L3更为安全;在纳米ZnO的制备中过程中是基于L.casei ATCC 393的发酵产物而不是菌体本身,这样有利于简化后续的分离、纯化过程,而且制备得到的产物纳纳米ZnO的产率和纯度更高。
下面结合附图和具体实施方式对本发明作详细说明。
附图说明
图1是本发明基于干酪乳酸杆菌分泌物制备纳米氧化锌的方法的流程图。
图2是本发明方法实施例1制备的纳米ZnO的扫描电镜(SEM)照片。
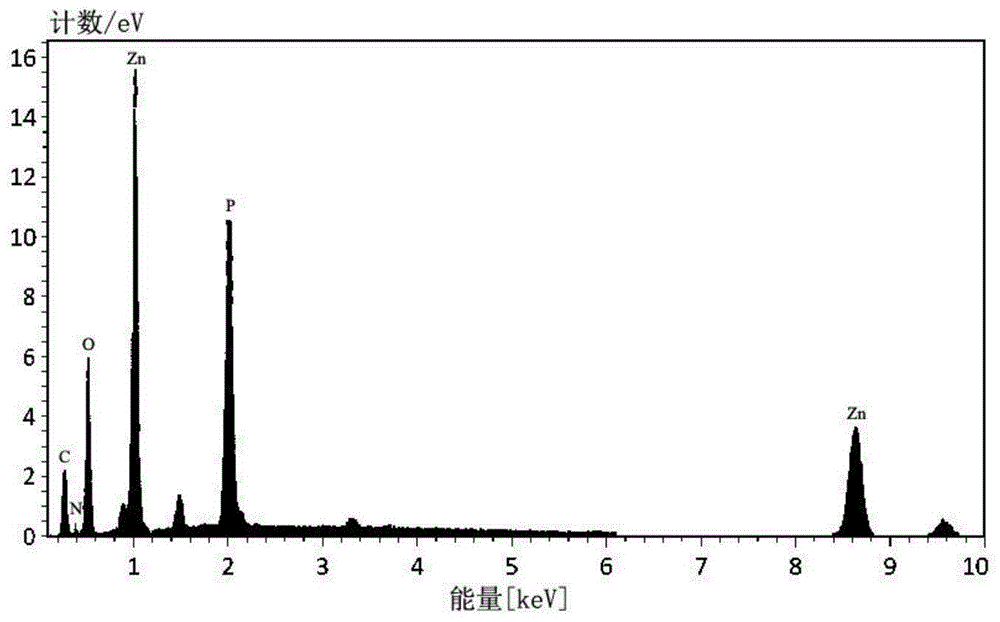
图3是本发明方法实施例1制备的纳米ZnO的能量色散X射线光谱图(EDX)。
具体实施方式
以下实施例参照图1-3。
实施例1:
步骤一、菌株活化:
用MRS固体培养基对干酪乳酸杆菌L.casei ATCC 393菌株进行活化培养,MRS固体培养基配方如下:蛋白胨10g/L,牛肉膏10g/L,酵母膏5g/L,柠檬酸氢二铵2g/L,葡萄糖20g/L,结晶乙酸钠5g/L,磷酸氢二钾2g/L,七水硫酸镁0.6g/L,一水硫酸锰0.25g/L,吐温801mL/L,琼脂15g/L,pH 6.4;将L.casei ATCC 393划线接种于MRS固体培养基,37℃厌氧培养48h。
步骤二、生物合成氢氧化锌:
将挑取的干酪乳酸杆菌L.casei ATCC 393的单菌落用MRS液体培养基培养,MRS液体培养基配方如下:蛋白胨10g/L,牛肉膏10g/L,酵母膏5g/L,柠檬酸氢二铵2g/L,葡萄糖20g/L,结晶乙酸钠5g/L,磷酸氢二钾2g/L,七水硫酸镁0.6g/L,一水硫酸锰0.25g/L,吐温801mL/L,pH 6.4;37℃静置培养48h后,收集发酵液,60℃恒温搅拌,在搅拌过程中加入终浓度0.15M乙酸锌,搅拌6h。
步骤三、分离提取氢氧化锌并转化为纳米ZnO:
收集搅拌后的溶液,于高速冷冻离心机,10000rpm,4℃离心10min,弃上清,收集沉淀;将沉淀用无菌水洗涤三次,于高速冷冻离心机,10000rpm,4℃离心10min,弃上清,收集沉淀;将沉淀冷冻干燥,使成分稳定;随后在马福炉中150℃煅烧12h,得到ZnO纳米颗粒。
干酪乳酸杆菌L.casei ATCC 393分泌物合成纳米ZnO的结构表征方法。
扫描电镜结果(SEM):
取实施例1中的纳米ZnO通过扫描电镜检测生物纳米ZnO表面的活性物质组成。
从图2可以看出,实施例1生产的纳米ZnO平均粒径为125nm。
能量色散X射线光谱结果(EDX):
取实施例1中的纳米ZnO通过能量色散X射线光谱检测生物纳米ZnO表面的活性物质组成。
从图3可以看出,实施例1制备的纳米ZnO表面包被有多糖及蛋白质等物质。
实施例2:
步骤一、菌株活化:
用MRS固体培养基对干酪乳酸杆菌L.casei ATCC 393菌株进行活化培养,MRS固体培养基配方如下:蛋白胨11g/L,牛肉膏11g/L,酵母膏4g/L,柠檬酸氢二铵1.5g/L,葡萄糖23g/L,结晶乙酸钠4g/L,磷酸氢二钾2.3g/L,七水硫酸镁0.5g/L,一水硫酸锰0.27g/L,吐温80 1.3mL/L,琼脂18g/L,pH 6.2;将L.casei ATCC 393划线接种于MRS固体培养基,于35℃厌氧培养36h;
步骤二、生物合成氢氧化锌:
将挑取的干酪乳酸杆菌L.casei ATCC 393的单菌落用MRS液体培养基培养,MRS液体培养基配方如下:蛋白胨11g/L,牛肉膏11g/L,酵母膏4g/L,柠檬酸氢二铵1.5g/L,葡萄糖23g/L,结晶乙酸钠4g/L,磷酸氢二钾2.3g/L,七水硫酸镁0.5g/L,一水硫酸锰0.27g/L,吐温80 1.3mL/L,pH 6.2;于35℃静置培养36h后,收集发酵液,55℃恒温搅拌,在搅拌过程中加入终浓度0.18M乙酸锌,搅拌5h;
步骤三、分离提取氢氧化锌并转化为纳米ZnO:
收集搅拌后的溶液,于高速冷冻离心机,9900rpm,4℃离心8min,弃上清,收集沉淀;将沉淀用无菌水洗涤三次,于高速冷冻离心机,9900rpm,4℃离心8min,弃上清,收集沉淀;将沉淀冷冻干燥,使成分稳定;随后在马福炉中140℃煅烧8h,得到纳米ZnO颗粒。
实施例3:
步骤一、菌株活化:
用MRS固体培养基对干酪乳酸杆菌L.casei ATCC 393菌株进行活化培养,MRS固体培养基配方如下:蛋白胨12g/L,牛肉膏12g/L,酵母膏6g/L,柠檬酸氢二铵2.5g/L,葡萄糖25g/L,结晶乙酸钠6g/L,磷酸氢二钾2.5g/L,七水硫酸镁0.5g/L,一水硫酸锰0.3g/L,吐温80 1.5mL/L,琼脂20g/L,pH 6.6;将L.casei ATCC 393划线接种于MRS固体培养基,于38℃厌氧培养42h;
步骤二、生物合成氢氧化锌:
将挑取的干酪乳酸杆菌L.casei ATCC 393的单菌落用MRS液体培养基培养,MRS液体培养基配方如下:蛋白胨12g/L,牛肉膏12g/L,酵母膏6g/L,柠檬酸氢二铵2.5g/L,葡萄糖25g/L,结晶乙酸钠6g/L,磷酸氢二钾2.5g/L,七水硫酸镁0.6g/L,一水硫酸锰0.3g/L,吐温80 1.5mL/L,pH 6.6;于38℃静置培养42h后,收集发酵液,65℃恒温搅拌,在搅拌过程中加入终浓度0.2M乙酸锌,搅拌5h;
步骤三、分离提取氢氧化锌并转化为纳米ZnO:
收集搅拌后的溶液,于高速冷冻离心机,11000rpm,4℃离心9min,弃上清,收集沉淀;将沉淀用无菌水洗涤三次,于高速冷冻离心机,11000rpm,4℃离心9min,弃上清,收集沉淀;将沉淀冷冻干燥,使成分稳定;随后在马福炉中160℃煅烧10h,得到纳米ZnO颗粒。
实施例4:
干酪乳酸杆菌L.casei ATCC 393分泌物合成纳米ZnO的化学组成分析方法。
应用原子吸收仪检测生物合成纳米ZnO颗粒中ZnO含量:
采用原子吸收光谱—火焰分光光度计法测定纳米ZnO颗粒中ZnO含量。准确称取标准品溶液,以不含ZnO的溶液为空白对照,以吸光度为纵坐标,浓度为横坐标,绘制标准曲线。准确称取一定量样品,加入HNO3硝化过夜至样品清澈透明,转移至容量瓶中。根据样品吸光度,从标准曲线中计算相应的ZnO的含量。
实施例5:
干酪乳酸杆菌L.casei ATCC 393分泌物合成纳米ZnO的抗菌活性分析。
利用产肠毒素大肠杆菌ETEC K88为病原菌模型,通过最小抑菌浓度等实验方法研究本发明制备的纳米ZnO的抗菌效果。取K88原始菌种划线,37℃过夜培养,挑单克隆于MH液体培养基中37℃、200rpm过夜培养,按比例(1:100)接种,37℃、200rpm摇至OD=0.6,加入终浓度为2%的纳米ZnO,37℃、200rpm过夜摇,观察其浑浊度,并测其OD600,计算实验结果。
本发明利用益生菌—干酪乳酸杆菌L.casei ATCC 393分泌物转化合成纳米ZnO,自行设计建立了一种纳米ZnO的制备技术,并对其化学组成、结构特征和抗菌活性进行了表征和评价。通过L.casei ATCC 393发酵后,分离菌体,直接利用分泌物合成氢氧化锌,再经过高温处理生成ZnO,并制备成粉剂、液体等抗菌制剂。通过益生菌L.casei ATCC 393制备的新型具有抗菌活性的微生态制剂可作为畜禽饲料添加剂用于疾病的预防和治疗。该发明解决了现有锌源添加剂安全性问题,以及现有生产技术流程复杂、周期长、成产成本高的问题。



评论
全部评论
共{{commentCount}}条{{rs.Msg_Content}}