本发明公开的一种基于含硫蛋白过表达提高微生物有机硒合成能力的方法,属于有机硒生物合成技术领域,通过给微生物基因组中导入外源含硫蛋白基因,并将其在高硒低硫环境中进行培养。在外源含硫蛋白过表达中,含硫氨基酸(半胱氨酸和甲硫氨酸)中的硫会被硒取代合成硒代硫氨基酸,进而合成含硒蛋白,实现微生物的高效有机硒合成。该技术基于硒与硫的替代竞争关系,提出了借用含硫蛋白进行有机硒合成的方案,通过生物技术手段构建含硫的外源蛋白,在转染的微生物中形成含硒蛋白,即有机硒。不仅高效富硒而且其安全性得以保障。
1.一种基于含硫蛋白过表达提高微生物有机硒合成能力的方法,其特征在于,包括以下步骤:1)氨基酸序列和基因序列的确定从蛋白质序列数据库中筛选出甲硫氨酸和半胱氨酸个数占全蛋白氨基酸个数20%以上的含硫蛋白,得到含硫蛋白的氨基酸序列;或者,直接设计含硫蛋白的氨基酸序列;再根据氨基酸序列反推其密码子序列,依据待改造的微生物的密码子偏好性,对密码子序列进行优化,得到可过量表达的含硫蛋白基因序列;2)重组表达载体的构建采用基因合成法合成含硫蛋白基因,并采用常规基因工程操作方法将其整合进表达型质粒中并转化进保存宿主中保存,获得重组表达载体;3)转化和筛选将重组表达载体导入待改造微生物宿主中,通过常规筛选验证步骤获得可过量表达含硫蛋白的重组微生物;4)表达将重组微生物在含硒环境中进行培养并表达,在微生物表达含硫蛋白时,环境中的硒被吸收以代替含硫氨基酸中的硫生成硒代硫氨基酸,进而合成含硒蛋白,得到富含有机硒的微生物。
2.根据权利要求1所述的基于含硫蛋白过表达提高微生物有机硒合成能力的方法,其特征在于,将富硫蛋白重组微生物培养于高硒低硫培养基环境中,高硒低硫培养基中硫含量为0~10μg/mL,硒含量为20~60μg/mL。
3.权利要求1或2所述的方法获得的富含有机硒的微生物作为食品添加剂的应用。
4.权利要求1或2所述的方法获得的富含有机硒的微生物作为饲料添加剂的应用。
5.权利要求1或2所述的方法获得的富含有机硒的微生物在制备富硒保健品中的应用。
6.如权利要求5所述的应用,其特征在于,所述富硒保健品为富含有机硒的保健品。
技术领域
本发明属于富硒技术领域,尤其是有机硒生产技术领域,涉及一种基于含硫蛋白过表达提高微生物有机硒合成能力/效果的方法和应用。
背景技术
硒是人体不可或缺的营养元素,在人体中硒能够抵抗病毒,延缓衰老,调节人体免疫系统,还具有改善视力、提高记忆力、防治风湿骨痛、呼吸、胃肠疾患等多种功能,人体缺硒会导致癌症、糖尿病、心血管疾病以及免疫系统疾病等。
与人体其它必需微量元素相比,硒在世界各地地壳中的分布极不均匀,高硒土壤常位于由富硒矿衍生而来的相对较小的局部地区,从宏观上看即呈点状。除此外,世界范围内大部分土壤都是缺硒的。研究表明,全世界有2/3的面积为缺硒地区,我国更是有3/4的面积为缺硒地区,属于严重缺硒地区,全世界含硒量最低的地区也在我国东北部。因为土壤缺硒,我国大部分地区的膳食硒不能满足人体对硒的需求量。据调查我国城市居民的饮食结构中,硒的成年人日摄入量大约在20-30微克范围,离中国营养学会提出的推荐值50-250微克相差甚远。因此,专家们提倡补硒,并指出“要像抓补碘一样来抓补硒工作”,以提高广大居民硒的摄入量,达到防病抗病的目的。
硒的存在形式有2种,一种是无机硒另一种是有机硒。天然存在的无机硒包括硒的氧化物如亚硒酸盐和硒酸盐以及硒化物如硒化氢和金属硒化物等,摄入过量无机硒会导致人体中毒,造成危害甚至死亡。因此无机硒只作为药物而不能作为保健品使用。无机硒只有经过生物转化,将无机硒转变为以共价键结合的硒代硫甲硫氨酸或硒代硫半胱氨酸等有机硒形式,才能降低其毒性,保证人群饮食安全。
为了降低硒的毒性,扩大补硒的安全范围,实现无机硒的有机化,长久以来人们一直在自然界筛选各种能够高效转化无机硒并富集有机硒的植物或微生物,以作为缺硒人群膳食硒补充剂,但遗憾的是结果不尽人意。一方面是由于天然种属中能够高效富硒的植物或微生物十分罕见,截至目前,高效富硒的天然种类罕见报道。另一方面,即便有个别种类,如陕南发现在被称为“聚硒王”的植物(壶瓶碎米荠),其富硒机理也不清楚,其中富集的硒究竟是有机硒还是无机硒,尚无定论。因为植物富硒机理不清楚,高硒牧草导致食草动物中毒死亡的案例时有发生,其食用安全性和食用价值也就难下定论。
目前提高微生物富硒能力的主要方法是通过人工筛选获得硒耐受程度更高的出发菌株,在发酵培养过程中提高培养基中无机硒含量使得微生物能够富集更多的含硒蛋白来提高微生物体内的有机硒含量,但截至目前仅发现啤酒酵母具有较高的耐受硒的能力,可能与其原本含有较高的蛋白质含量有关。但啤酒酵母营养条件苛刻,用于富硒酵母生产时产量较低,导致较高的生产成本,富硒酵母产品价格很高,超出普通人群消费能力。因此,寻求产量高且富有机硒能力强的微生物菌株,始终是科学家努力达成的目标之一。
发明内容
为了克服现有技术存在的缺陷,本发明的目的在于提供一种基于含硫蛋白过表达提高微生物有机硒合成能力的方法及应用,该方法安全性好,能够实现高效有机硒的生物合成。
本发明是通过以下技术方案来实现:
本发明公开的基于含硫蛋白过表达提高微生物有机硒合成能力的方法,包括以下步骤:
1)氨基酸序列和基因序列的确定:
设计含硫蛋白(包括含硫多肽,余同)的氨基酸序列,或从蛋白质序列数据库中筛选出合适的含硫蛋白氨基酸序列(甲硫氨酸和半胱氨酸个数占全蛋白氨基酸个数20%以上的含硫蛋白的氨基酸序列,如金属硫蛋白的氨基酸序列),再根据氨基酸序列反推其密码子序列;依据待改造的微生物的密码子偏好性,对密码子序列进行优化,得到可过量表达的含硫蛋白基因序列;
2)重组表达载体的构建:采用基因合成法合成含硫蛋白基因,并采用常规基因工程操作方法将其整合进表达型质粒中并转化进保存宿主中保存,获得重组表达载体;
3)转化和筛选:将重组表达载体导入待改造微生物宿主中,通过常规筛选验证步骤获得可过量表达含硫蛋白的重组微生物;
4)表达:将重组微生物在含硒环境中进行培养并表达,在微生物表达含硫蛋白时,环境中的硒被吸收以代替含硫氨基酸中的硫生成硒代硫氨基酸,进而合成含硒蛋白,得到富含有机硒的微生物。
优选地,将富硫蛋白重组微生物培养于高硒低硫培养基环境中,高硒低硫培养基中硫含量为0~10μg/mL,硒含量为20~60μg/mL。
步骤2)中,将含硫蛋白基因整合进表达型质粒中并转化进保存宿主中,经培养扩增后提取纯化质粒,获得重组表达载体。
本发明还公开了上述获得的富含有机硒的益生微生物的应用。
如作为食品添加剂的应用,作为饲料添加剂的应用,或者在制备富硒保健品中的应用。
所述的富有机硒的微生物均可以作为原材料从中进一步提取纯化含硫蛋白作为高纯有机硒产品满足人群需求。
与现有技术相比,本发明具有以下有益的技术效果:
本发明通过给微生物基因组中导入外源含硫蛋白基因,并将其在高硒低硫环境中进行培养,在导入的外源含硫蛋白过表达过程中,含硫氨基酸(半胱氨酸和甲硫氨酸)中的硫会被硒取代而合成硒代硫氨基酸,进而合成含硒蛋白,实现有机硒的微生物高效合成。该方法基于硒与硫的替代竞争关系,提出了借用含硫蛋白重组微生物进行有机硒高效生物合成的方案。一方面通过生物技术手段构建含硫蛋白重组微生物,另一方面将其培养在高硒低硫的培养环境中,当其代谢生长时,硒可被微生物细胞吸收而替代含硫蛋白中的硫元素,合成含硒蛋白;重组微生物合成的硒蛋白,不仅高效富硒而且其安全性有保障。通过实验验证表明,其有机硒转化效果明显;比起天然筛选的耐硒啤酒酵母,要求的营养条件粗放,明显可以提升生物物质产量,最终提高有机硒产量。此外,所构建的微生物菌株可以任意培养繁殖进行扩大,易于实现产业化。
在应用方面,富有机硒的益生菌,可直接用作硒保健品或食品添加剂,供给人们日常用硒补充剂;所有富有机硒的微生物均可作为有机硒的原材料,从中进一步提取纯化含硫蛋白作为高纯有机硒产品满足人群需求。
附图说明
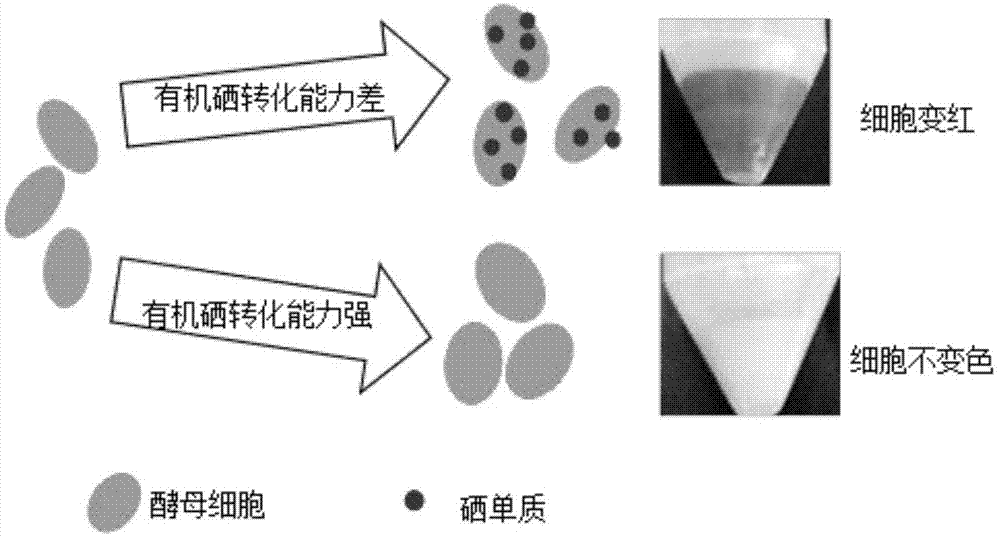
图1为色差法评价微生物富硒能力原理示意图;
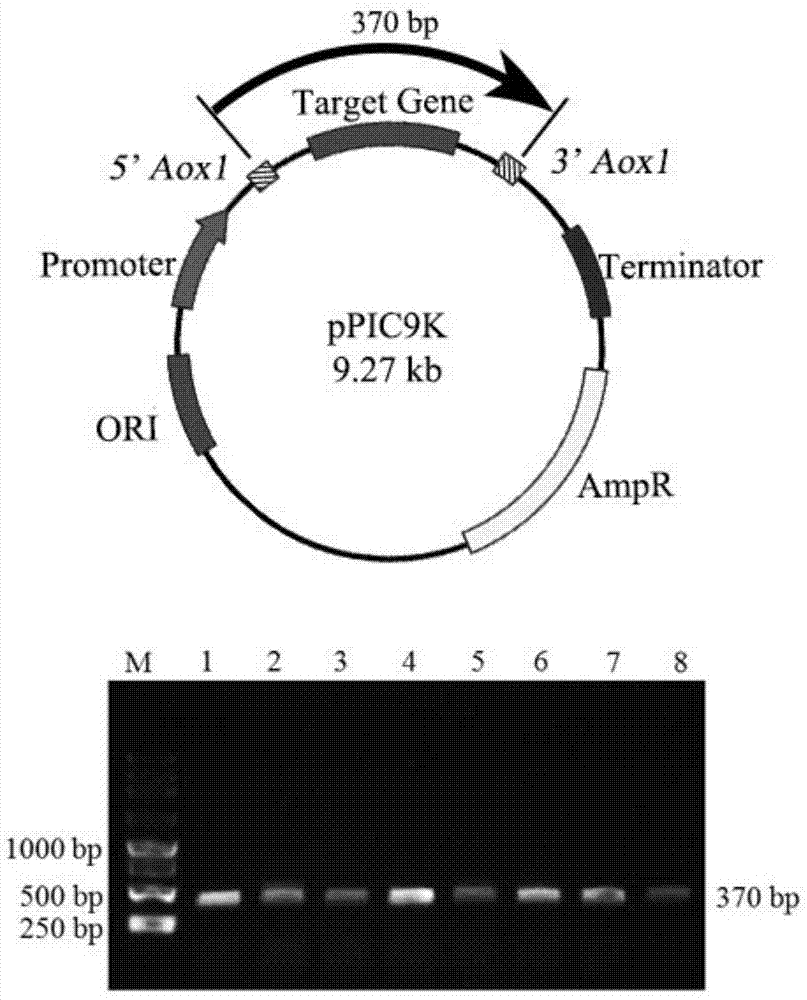
图2为人工硫蛋白AC40重组酵母质粒构建示意图及PCR验证结果;
图3为人工硫蛋白AC40和MC74重组酵母菌更多转化红色纳米硒为有机硒现象;
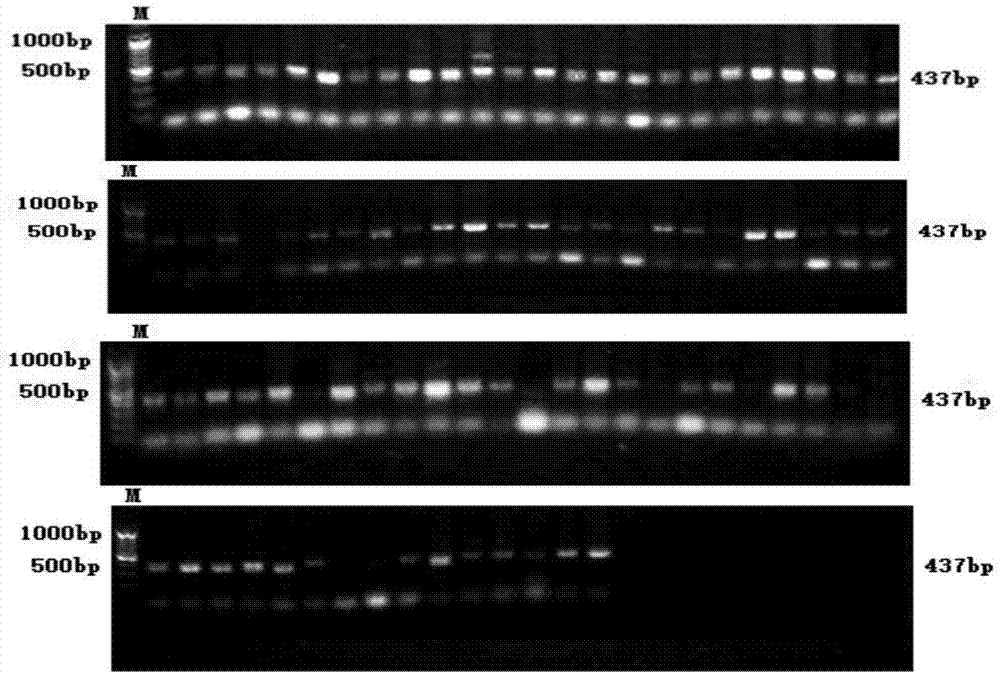
图4为人工硫蛋白MC74重组酵母菌PCR验证结果;
图5为天然硫蛋白MT重组大肠杆菌PCR验证结果;
图6为天然硫蛋白MT重组大肠杆菌更多转化红色纳米硒为有机硒现象;
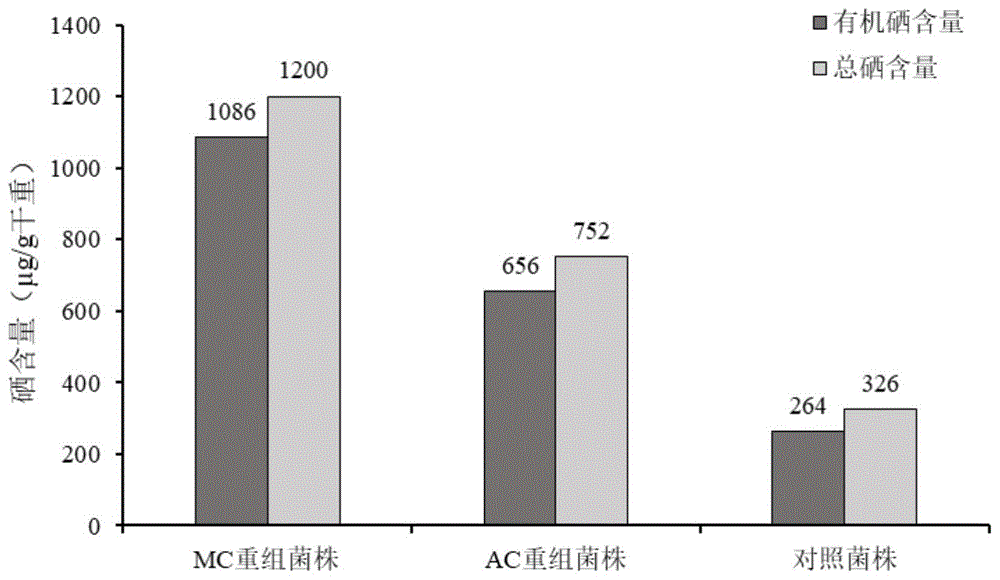
图7为人工硫蛋白重组菌AC40和MC74比原始菌株具有更高的总硒和有机硒含量;
图8为天然硫蛋白MT重组菌比原始菌株具有更高的总硒和有机硒含量。
具体实施方式
下面结合具体的实施例对本发明做进一步的详细说明,所述是对本发明的解释而不是限定。
本发明通过含硫蛋白基因的过表达,在高硒低硫条件下转化无机硒为有机硒,包括以下操作步骤:
1)氨基酸序列和基因序列的确定:设计含硫蛋白(包括含硫多肽,余同)的氨基酸序列,或从现有物种中筛选合适的含硫蛋白氨基酸序列,再根据氨基酸序列反推其密码子序列;依据待改造的微生物的密码子偏好性,对密码子序列进行优化,得到可过量表达的含硫蛋白基因序列;
2)表达载体的构建:采用基因合成法合成基因,采用常规基因工程法将其整合进表达型质粒中并转化进保存宿主中保存;若有必要,可将构建的重组载体在保存宿主中培养扩增后提取纯化,获得重组表达载体。
3)转化和筛选:将提取纯化的重组表达载体导入待改造微生物宿主中,通过常规筛选验证步骤获得可过量表达含硫蛋白的重组微生物;
4)表达:将重组微生物在含硒环境中进行培养并表达,在微生物表达含硫蛋白时,环境中的硒被吸收以代替含硫氨基酸中的硫生成硒代硫氨基酸(包括硒代硫甲硫氨酸和硒代硫半胱氨酸),进而合成含硒蛋白,得到富含有机硒的微生物。
应用:富含有机硒的益生微生物可直接用作食品添加剂、饲料添加剂或硒保健品使用,所有富含有机硒的微生物均可以作为原材料从中进一步提取纯化含硫蛋白作为高纯有机硒产品满足人群需求。
在微生物研究中也发展了一种简便的对微生物富硒能力进行半定量的方法,即色差法。其原理为,微生物同化无机硒为有机硒的过程是,首先将正四价的亚硒酸盐或正六价的硒酸盐中的硒还原为零价的硒元素,再进一步将零价的硒还原并整合进入氨基酸,被有机化的硒相当于负二价。当微生物培养基中添加过量的无机硒(亚硒酸盐或硒酸盐)时,微生物细胞不能将多余的无机硒同化为自身无色的硒代硫氨基酸或硒代硫蛋白,但可以将过量的无机硒还原成零价的单质硒。单质硒进而聚合成粒径大小在纳米级的颗粒,分散在微生物细胞内和表面,从而使细胞呈现红色(张顺涛.高生物量富硒酵母的选育及富硒保健酒的研制[D].青岛:中国海洋大学,2009;郭金,刘莉君.酵母突变株最优富硒发酵条件的研究[J].安徽农业科学,2008,36(2):490-492)。色差法的原理图如图1所示。
根据以上原理,在相同硒浓度条件下培养不同有机硒转化能力的酵母菌,根据培养后体系中红色深浅则可以判断微生物的富硒能力,红色越深说明其转化为自身有机硒的能力越差,即富硒能力越差。相反则证明富硒能力越强。按照颜色变化情况,也可以估计适合含硫酵母进行硒转化的培养基中硒的浓度范围,即以微生物颜色不变红情况下较高的硒浓度为好,因为红色的出现表示微生物已经不能将无机硒有机化了。
下面以毕赤酵母和大肠杆菌为例,对本发明作进一步详细说明。步骤和使用的基因载体以及菌株载体可以是如下所述,但不限于此。凡是符合分子生物学原理的、以有机硒生物合成为目的的方法,均在我们申报保护之列。
实施例1人工设计AC含硫蛋白重组酵母菌的构建以及富硒能力的测定
1、人工含硫蛋白AC及其基因序列的设计
1)人工设计丙氨酸-半胱氨酸多聚体作为含硫蛋白,共40个氨基酸(简称AC40),其氨基酸序列为(AC)20。其中,A代表丙氨酸,C代表半胱氨酸,含硫氨基酸为20个,占到50%。
AC基因序列加上起始和终止密码子共长126bp,序列如下:
ATG(GCCTGC)20TGA(如SEQ.ID.NO.1所示)。
2)根据酵母密码子偏好性,将AC40的密码子序列进行优化,确定其基因序列,并在上下游加入酶切位点如下所示:
2、重组表达载体的构建
将上述设计的基因序列送金唯智生物技术有限公司合成,并将基因序列重组在穿梭质粒pPIC9K上,构建成pPIC9K-ac载体,将pPIC9K-ac载体保存至大肠杆菌DH5α中。
3、重组AC载体的转化
采用质粒提取试剂盒从转染pPIC9K-ac的大肠杆菌DH5α中提取质粒,并按照酵母菌基因工程操作步骤(INVITROGEN Corp.A Manual of Methods of Expression ofRecombinant Proteins in Pichia pastoris[M].Invitrogen Crop,l998.)用Sal I酶对质粒单酶切线性化,回收纯化后采用电击法(Lin-cereghino J,Wong W W,Xiong S,etal.Condensed protocol for competent cell preparation and transformation ofthe methylotrophic yeast Pichia pastoris[J].Biotechniques,2005,38(1):48-50)转入毕赤酵母细胞基因组。
4、AC重组酵母菌的筛选
将转化后的酵母菌涂布于缺乏组氨酸的培养基(MD平板)上,28℃恒温培养48h,挑取MD平板上的阳性克隆转接至氨基糖苷类抗生素G418培养基上,28℃恒温培养48h,挑取G418培养基的阳性克隆进行菌落PCR验证,结果见图2。从图2可以看出,经菌落PCR验证,AC重组酵母菌株构建成功。
该酵母受体是组氨酸缺陷型,不能在MD平板上生长,而pPIC9K质粒上携带组氨酸合成基因,转化成功的菌株可在MD平板上生长,因此选用MD作为筛选用培养基。其余酵母为宿主的实施例原理同此。
5、AC重组酵母富硒能力的色差法初步评价
将构建成功的AC重组酵母和出发酵母菌株(对照)分别接种至硒含量0、20、45、60μg/mL,硫含量5μg/mL的培养基中,28℃条件下进行富硒培养,观察各组酵母颜色变化,通过色差法对酵母菌的富硒能力进行初步评价,结果如图3所示。结果表明,在硒含量为20μg/mL的培养基中培养12小时后,对照菌培养液变红,可推测有红色单质硒积累,说明对照菌不能将该浓度下的全部无机硒转化成无色的有机硒蛋白;而此浓度下的AC重组酵母菌并未出现红色,说明含硫蛋白菌株能够将此浓度下的全部红色单质硒转化为无色的有机硒蛋白,而不会造成单质硒积累,菌液颜色也不会出现红色。
色差法实验结果还表明,当培养基硒含量提高到45μg/mL时,AC重组酵母培养液颜色开始变红,此即富硒培养硒浓度上限。根据培养基硒含量比例可推测,AC重组酵母有机硒转化能力约为出发对照菌株的2倍以上。
6、AC重组酵母菌富硒能力的定量测定
将构建成功的AC重组酵母接种至硒含量45μg/mL,硫含量5μg/mL的培养基中,28℃条件下进行富硒培养72h,测定AC重组酵母中总硒及有机硒含量,结果如表1和图7所示。从表中数据可以看出,AC重组酵母菌总硒含量和有机硒含量相比于对照菌株分别提高了148%和133%,分别是对照酵母菌株的2.5和2.3倍,跟色差法估计结果相符。
表1AC重组菌株总硒及有机硒含量
生物体在硒代谢中,首先是将Se4+(亚硒酸根)转化为Se0(红色纳米硒),进而转化成Se2-的硒代硫氨基酸和硒蛋白,因此在酵母菌颜色未变红情况下,总硒含量越高,有机硒含量也越高,测定结果与理论推测一致。
以上结果说明,酵母细胞中导入含硫蛋白基因并使其在高硒低硫培养基中过表达,可以促使酵母高效将无机硒转化为有机硒。
实施例2人工设计MC含硫蛋白重组酵母菌的构建以及富硒能力的测定
1、人工含硫蛋白MC及其基因序列的设计
1)人工设计由甲硫氨酸和半胱氨酸构成的含硫蛋白,共74个氨基酸(简称MC74)其中包含几个间隔的甘氨酸满足蛋白结构的要求,序列为GG(MMMMMMGGCCGG)6。其中,G代表甘氨酸,M代表甲硫氨酸,C代表半胱氨酸,含硫氨基酸个数为48个,占到65%左右。MC基因序列加上起始和终止密码子共长228bp,序列如下:
ATGGGTGGT(ATGATGATGATGATGATGGGTGGTTGTTGTGGTGGT)6T GA(如SEQ.ID.NO.2所示)。
2)根据酵母密码子偏好性,将MC74的密码子序列进行优化,确定其基因序列,并在上下游加入酶切位点如下所示:
2、重组表达载体的构建
将上述设计的MC74基因序列送金瑞斯生物技术有限公司合成,并将基因序列重组在穿梭质粒pPIC9K上,构建成pPIC9K-mc载体,将pPIC9K-mc载体保存至大肠杆菌DH5α中。
3、重组MC载体的转化
采用质粒提取试剂盒从转染pPIC9K-mc的大肠杆菌DH5α中提取质粒,并按照酵母菌基因工程操作步骤(同实施例1方法)用Sal I酶对质粒单酶切线性化,回收纯化后采用电击法(同实施例1方法)转入毕赤酵母细胞基因组。
4、MC重组酵母菌的筛选
将转化后的酵母菌涂布于缺乏组氨酸的培养基(MD平板)上,28℃恒温培养48h,挑取MD平板上的阳性克隆转接至氨基糖苷类抗生素G418培养基上,28℃恒温培养48h,挑取G418培养基的阳性克隆进行菌落PCR验证,结果如图4。从图4可以看出,经菌落PCR验证,MC重组酵母菌株构建成功。
5、MC重组酵母富硒能力的色差法初步评价
将构建成功的MC重组酵母和出发酵母菌株(对照)分别接种至硒含量0、20、45、60μg/mL,硫含量5μg/mL的培养基中,28℃条件下进行富硒培养,观察各组酵母颜色变化,通过色差法对酵母菌的富硒能力进行初步评价,结果如图3所示。
结果表明,在硒含量为20μg/mL的培养基中培养12小时后,对照菌培养液变红,可推测有红色单质硒积累,说明对照菌不能将该浓度下的全部无机硒转化成无色的有机硒蛋白;而此浓度下的MC重组酵母菌并未出现红色,说明含硫蛋白菌株能够将此浓度下的全部红色单质硒转化为无色的有机硒蛋白,而不会造成单质硒积累,菌液颜色也不会出现红色。
色差法实验结果还表明,当培养基硒含量提高到60μg/mL时,MC重组酵母培养液颜色开始变红,此即富硒培养硒浓度上限。根据培养基硒含量比例可推测,MC重组酵母有机硒转化能力约为出发对照菌株的3倍以上。
6、MC重组酵母菌富硒能力的定量测定
将构建成功的MC重组酵母接种至硒含量60μg/mL,硫含量5μg/mL的培养基中,28℃条件下进行富硒培养72h,测定MC重组酵母中总硒及有机硒含量,结果如表2和图7所示。从表中数据可以看出,MC重组酵母菌总硒含量和有机硒含量相比于对照菌株分别提高了311%和268%,分别是对照酵母菌株的4.11和3.68倍,跟色差法估计结果相符。
表2MC重组菌株总硒及有机硒含量
以上结果说明,酵母细胞中导入含硫蛋白基因并使其在高硒低硫培养基中过表达,可以促使酵母高效将无机硒转化为有机硒。
实施例3天然MT含硫蛋白重组细菌的构建以及富硒能力的测定
1、天然兔源金属硫蛋白MT及其基因序列
天然含硫蛋白中最具代表性的为金属硫蛋白MT,为生物进化过程中自然形成的金属结合蛋白,含有较多的含硫氨基酸——半胱氨酸。研究表明MT序列高度保守,半胱氨酸含量总氨基酸的1/3左右。本实施例中从NCBI蛋白序列库中选取了兔源MT蛋白作为天然含硫蛋白的代表,其氨基酸序列为:
MDPNCSCPTGGSCSCAGSCTCKACRCPSCKKSCCSCCPVGCAKCAQGCVCKGASDKCSCCA。
共61个氨基酸(MT61),其中C代表半胱氨酸,共20个,含硫氨基酸占32.8%。加上终止密码子,该基因序列长186bp,如下所示:
ATGGATCCCAACTGCTCCTGCCCCACTGGCGGCTCCTGCAGCTGTGCTGGCTCCTGCACCTGCAAGGCCTGCAGATGTCCCTCCTGCAAGAAGAGCTGCTGCTCCTGCTGCCCTGTGGGCTGTGCCAAGTGTGCCCAGGGCTGTGTCTGCAAAGGGGCCTCGGACAAGTGCAGCTGCTGCGCCTGA(如SEQ.ID.NO.3所示)。
根据大肠杆菌密码子偏好性,将MT61的密码子序列进行优化,确定其基因序列,并在上下游加入酶切位点如下所示:
2、重组表达载体的构建
将上述优化的MT61基因序列通过金唯智生物技术有限公司合成,并将基因序列重组在质粒pET-28a上,构建成pET-28a-mt载体,将pET-28a-mt载体保存至大肠杆菌DH5α中。
3、重组MT载体的转化
采用质粒提取试剂盒从含pET-28a-mt的大肠杆菌DH5α中提取质粒,并按照大肠杆菌基因工程操作步骤(Green MR,Sambrook J,Russell D W,et al.Molecular cloning:Alaboratory manual(Fourth Edition)[M].Beijing:Science Press,2013)用氯化钙法转入大肠杆菌BL21。
4、MT重组大肠杆菌BL21的筛选
将转化后的产物涂布于含有氨苄霉素抗性的LB平板上,37℃恒温培养过夜,挑取阳性克隆进行菌落PCR,筛选获得MT重组大肠杆菌BL21(pET-28a-mt),结果如图5。从图5可以看出,经菌落PCR验证,MT重组大肠杆菌BL21(pET-28a-mt)构建成功。
5、MT重组大肠杆菌富硒能力的色差法初步评价
将构建成功的MT重组大肠杆菌和出发大肠杆菌(对照)分别接种至硒含量20μg/mL,硫含量5μg/mL的培养基中,28℃条件下进行富硒培养,观察各组大肠杆菌颜色变化,通过色差法对大肠杆菌的富硒能力进行初步评价,结果如图6所示。结果表明,在硒含量为20μg/mL的培养基中培养12小时后,对照菌培养液变红,可推测有红色单质硒积累,说明对照菌不能将该浓度下的全部无机硒转化成无色的有机硒蛋白;而此浓度下的MT重组大肠杆菌并未出现红色,说明含硫蛋白菌株能够将此浓度下的全部红色单质硒转化为无色的有机硒蛋白,而不会造成单质硒积累,菌液颜色也不会出现红色。
色差法实验结果还表明,当培养基硒含量提高到35μg/mL时,构建的MT重组大肠杆菌培养液颜色才开始变红,此即富硒培养硒浓度上限。根据培养基硒含量比例可推测,MT重组大肠杆菌有机硒转化能力约为出发对照菌株的1.7倍左右。
6、MT重组大肠杆菌富硒能力的定量测定
将构建成功的MT重组大肠杆菌接种至硒含量35μg/mL,硫含量5μg/mL的培养基中,37℃条件下进行富硒培养48h,测定MC重组细菌中总硒及有机硒含量,结果如表3和图8所示。从表中数据可以看出,MT重组大肠杆菌总硒含量和有机硒含量相比于对照菌株分别提高了93.6%和72.7%,分别是对照菌株的1.9和1.7倍,跟色差法估计结果相符。
表3MT重组菌株总硒及有机硒含量
以上结果说明,大肠杆菌中导入含硫蛋白基因并使其在高硒低硫培养基中过表达,可以促使大肠杆菌高效将无机硒转化为有机硒。
序列表
<110> 西安交通大学
<120> 一种基于外源富硫蛋白表达提高微生物富硒能力的方法
<160> 3
<170> SIPOSequenceListing 1.0
<210> 1
<211> 126
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 1
atggcctgcg cctgcgcctg cgcctgcgcc tgcgcctgcg cctgcgcctg cgcctgcgcc 60
tgcgcctgcg cctgcgcctg cgcctgcgcc tgcgcctgcg cctgcgcctg cgcctgcgcc 120
tgctga 126
<210> 2
<211> 228
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 2
atgggtggta tgatgatgat gatgatgggt ggttgttgtg gtggtatgat gatgatgatg 60
atgggtggtt gttgtggtgg tatgatgatg atgatgatgg gtggttgttg tggtggtatg 120
atgatgatga tgatgggtgg ttgttgtggt ggtatgatga tgatgatgat gggtggttgt 180
tgtggtggta tgatgatgat gatgatgggt ggttgttgtg gtggttga 228
<210> 3
<211> 186
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 3
atggatccca actgctcctg ccccactggc ggctcctgca gctgtgctgg ctcctgcacc 60
tgcaaggcct gcagatgtcc ctcctgcaag aagagctgct gctcctgctg ccctgtgggc 120
tgtgccaagt gtgcccaggg ctgtgtctgc aaaggggcct cggacaagtg cagctgctgc 180
gcctga 186



评论
全部评论
共{{commentCount}}条{{rs.Msg_Content}}