本发明公开了一种用于制备类过敏反应的双抗夹心试剂盒配对抗体的多肽及其应用,属于生物医学技术领域。所述双抗夹心试剂盒的配对抗体的多肽包括用于制备鼠单克隆抗体的多肽和用于制备兔多克隆抗体的多肽;其中:所述用于制备鼠单克隆抗体的多肽的氨基酸序列如SEQ ID NO:1所示;所述用于制备兔多克隆抗体的多肽的氨基酸序列如SEQ ID NO:2所示。该多肽为类过敏反应特异性受体MRGPRX2蛋白的具有免疫原性的多肽,可用于制备ELISA鼠单克隆包被抗体和兔多克隆检测抗体,成功制备了双抗夹心ELISA,其中以单克隆抗体为包被抗体,多克隆抗体为检测抗体,验证了其在临床中的应用,这将有助于类过敏反应特异性受体MRGPRX2的研究工作,对临床上指导用药的安全性具有重要意义。
1.一种用于制备类过敏反应的双抗夹心试剂盒的配对抗体的多肽,其特征在于,所述双抗夹心试剂盒的配对抗体的多肽包括用于制备鼠单克隆抗体的多肽和用于制备兔多克隆抗体的多肽;其中:所述用于制备鼠单克隆抗体的多肽的氨基酸序列如SEQ ID NO:1所示;所述用于制备兔多克隆抗体的多肽的氨基酸序列如SEQ ID NO:2所示。
2.如权利要求1用于制备类过敏反应的双抗夹心试剂盒的配对抗体的多肽,其特征在于,所述用于制备鼠单克隆抗体的多肽的表位是Mrgprx2蛋白第133-144个氨基酸序列。
3.如权利要求1用于制备类过敏反应的双抗夹心试剂盒的配对抗体的多肽,其特征在于,所述用于制备兔多克隆抗体的多肽的表位是Mrgprx2蛋白第286-330个氨基酸序列。
4.权利要求1所述用于制备类过敏反应的双抗夹心试剂盒的配对抗体的多肽在制备检测Mrgprx2蛋白的抗体中的应用。
5.一种含有权利要求1所述的用于制备类过敏反应的双抗夹心试剂盒的配对抗体的多肽的检测试剂盒。
6.权利要求5所述的检测试剂盒检测Mrgprx2蛋白的应用。
7.如权利要求6所述的应用,其特征在于,检测Mrgprx2蛋白时,以特异性识别如SEQ IDNO:1所示的多肽的单克隆抗体为包被抗体,以生物素标记的特异性识别如SEQ ID NO:2所示的多肽的多克隆抗体为检测抗体,且所述包被抗体和检测抗体能够筛选为ELISA配对抗体,通过双抗体夹心法被识别。
技术领域
本发明属于生物医学技术领域,涉及一种用于制备类过敏反应的双抗夹心试剂盒配对抗体的多肽及其应用。
背景技术
类过敏反应(anaphylactoid reaction or pseudo-allergy reaction)是指药物在初次使用时,在患者体内即可引发过敏样症状,其临床表现为血管扩张引起的红斑,水肿等局部皮肤症状,胸闷、心悸、血压升高、呼吸困难等呼吸系统症状,流涎、恶心、呕吐、腹泻、厌食等消化系统症状,严重的可引发呼吸循环衰竭,致使患者休克甚至死亡。由于类过敏反应与Ⅰ型过敏反应具有相似的症状,常被误认为Ⅰ型过敏反应,但它与Ⅰ型过敏反应具有本质的区别。类过敏反应的症状通常在给药后数分钟以内即可出现,较迅速,不需要潜伏期,不需要提前与抗原接触的致敏过程,首次接触药物即可产生过敏症状,在患者血清中并未见IgE的浓度升高。近年来,随着对各类药物不良反应的监测,类过敏反应在临床中的发生频率呈逐渐上升趋势,由于其危害性较大,受到越来越多的关注。
研究发现类过敏刺激物首先激活细胞膜上的G蛋白,进而激活蛋白激酶C和Ca2+通道,使内质网释放Ca2+进入细胞内。伴随着细胞内Ca2+浓度增加,肥大细胞和嗜碱性粒细胞内的颗粒囊泡向胞浆膜移动并释放生物介质,从而引发类过敏反应。《Nature》等多种权威杂志的大量报道证实,类过敏刺激物所激活的G蛋白为MRGPRS(MAS-Related G Protein-coupled Receptors),该受体不依赖IgE,可直接介导肥大细胞活化,诱导肥大细胞脱颗粒。此类受体在各种属、组织和器官的表达类型并不相同:其中MRGPRX2在人源肥大细胞中表达;该受体胞外区为感应区,特异性不高,当胞外被脱颗粒多肽、P物质、Compound 48/80、β-防御素等多种物质激活后,胞内区信号触发,引起肥大细胞激活,释放组胺等颗粒物质,刺激细胞旁分泌,从而影响到周围细胞。
MRGPRX2是很多小分子药物引起类过敏、假性过敏的作用靶标。目前针对MRGPRX2的用于实验室研究的抗体和蛋白还存在缺口,更甚于针对MRGPRX2的临床检测试剂盒尚无相关报道。
发明内容
为了克服上述现有技术的缺点,本发明的目的在于提供一种用于制备类过敏反应的双抗夹心试剂盒配对抗体的多肽及其应用。
为了达到上述目的,本发明采用以下技术方案予以实现:
本发明公开的一种用于制备类过敏反应的双抗夹心试剂盒的配对抗体的多肽,所述双抗夹心试剂盒的配对抗体的多肽包括用于制备鼠单克隆抗体的多肽和用于制备兔多克隆抗体的多肽;其中:
所述用于制备鼠单克隆抗体的多肽的氨基酸序列如SEQ ID NO:1所示;
所述用于制备兔多克隆抗体的多肽的氨基酸序列如SEQ ID NO:2所示。
优选地,所述用于制备鼠单克隆抗体的多肽的表位是Mrgprx2蛋白第133-144个氨基酸序列。
优选地,所述用于制备兔多克隆抗体的多肽的表位是Mrgprx2蛋白第286-330个氨基酸序列。
本发明还公开了上述用于制备类过敏反应的双抗夹心试剂盒的配对抗体的多肽在制备检测Mrgprx2蛋白的抗体中的应用。
本发明还公开了一种含有上述的用于制备类过敏反应的双抗夹心试剂盒的配对抗体的多肽的检测试剂盒。
本发明还公开了上述检测试剂盒检测Mrgprx2蛋白的应用,在检测Mrgprx2蛋白时,以特异性识别如SEQ ID NO:1所示的多肽的单克隆抗体为包被抗体,以生物素标记的特异性识别如SEQ ID NO:2所示的多肽的多克隆抗体为检测抗体,且所述包被抗体和检测抗体能够筛选为ELISA配对抗体,通过双抗体夹心法被识别。
与现有技术相比,本发明具有以下有益效果:
本发明提供了用于制备类过敏反应的双抗夹心试剂盒配对抗体的多肽,该多肽由用于制备鼠单克隆抗体的10个氨基酸组成的多肽(如SEQ ID NO:1所示,MRGPRX2蛋白第134-144个氨基酸序列)和用于制备兔多克隆抗体的45个氨基酸组成多肽(如SEQ ID NO:2所示,MRGPRX2蛋白第286-330个氨基酸序列)组成,该多肽为类过敏反应特异性受体MRGPRX2蛋白的具有免疫原性的多肽,通过研究发现,其具有很强的免疫原性,因此可用于制备ELISA鼠单克隆包被抗体和兔多克隆检测抗体,这将有助于类过敏反应特异性受体MRGPRX2的研究工作,通过单克隆技术和多克隆技术制备出鼠单克隆抗体和兔多克隆抗体。
本发明成功制备了双抗夹心ELISA试剂盒,这对研制患者在用药过程中发生类过敏反应风险的MRGPRX2临床检测试剂盒提供科研思路,对临床上指导用药的安全性具有重要意义。
附图说明
图1为DNAstar软件分析图;
图2是通过间接ELISA方法鉴定纯化单克隆抗体抗体效价结果图;。
图3是通过Dot blot方法鉴定纯化多克隆抗体效价结果图;
图4是建立双抗夹心法的标准曲线。
图5是所建立的方法的临床应用。
具体实施方式
为了使本技术领域的人员更好地理解本发明方案,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分的实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都应当属于本发明保护的范围。
需要说明的是,本发明的说明书和权利要求书及上述附图中的术语“第一”、“第二”等是用于区别类似的对象,而不必用于描述特定的顺序或先后次序。应该理解这样使用的数据在适当情况下可以互换,以便这里描述的本发明的实施例能够以除了在这里图示或描述的那些以外的顺序实施。此外,术语“包括”和“具有”以及他们的任何变形,意图在于覆盖不排他的包含,例如,包含了一系列步骤或单元的过程、方法、系统、产品或设备不必限于清楚地列出的那些步骤或单元,而是可包括没有清楚地列出的或对于这些过程、方法、产品或设备固有的其它步骤或单元。
本发明公开的用于制备类过敏反应的双抗夹心试剂盒的配对抗体的多肽,由用于制备鼠单克隆抗体的多肽和用于制备兔多克隆抗体的多肽组成。
其中,用于制备鼠单克隆抗体的多肽由10个氨基酸组成,其多肽序列为:IWYRCRRPRH(如SEQ ID NO:1所示),该多肽的表位是MRGPRX2蛋白第134-144个氨基酸序列。
用于制备兔多克隆抗体的多肽由45个氨基酸组成,其多肽序列为:
RKQWRLQQPILKLALQRALQDIAEVDHSEGCFRQGTPEMSRSSLV(如SEQ ID NO:2所示),该多肽的表位是MRGPRX2蛋白第286-330个氨基酸序列。
本发明公开的上述用于制备类过敏反应的双抗夹心试剂盒的配对抗体的多肽具有很强的免疫原性。
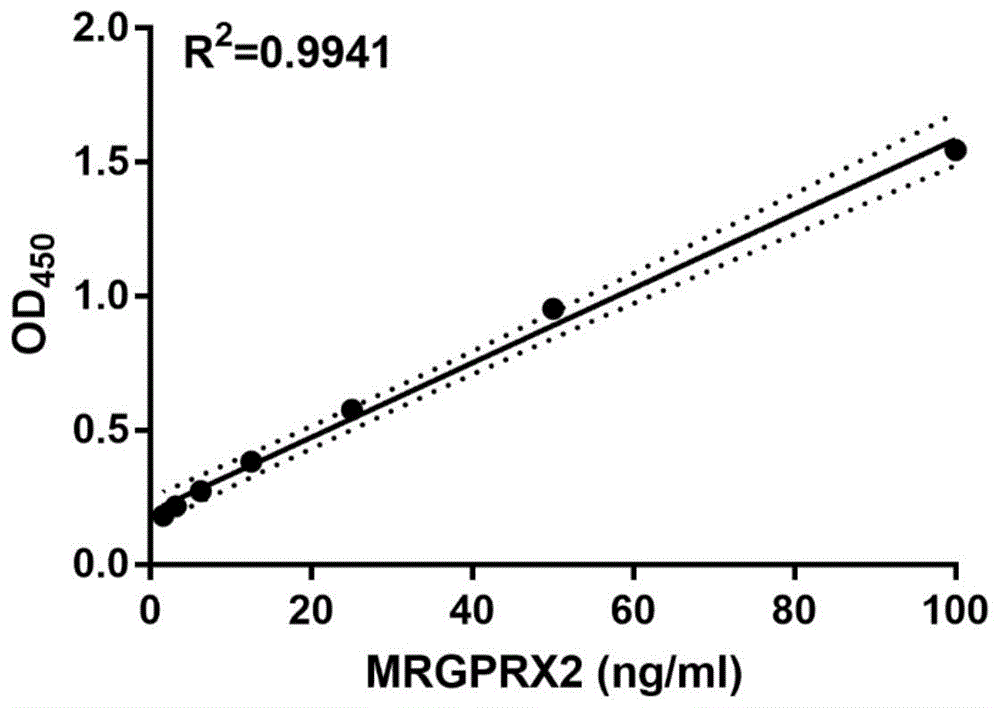
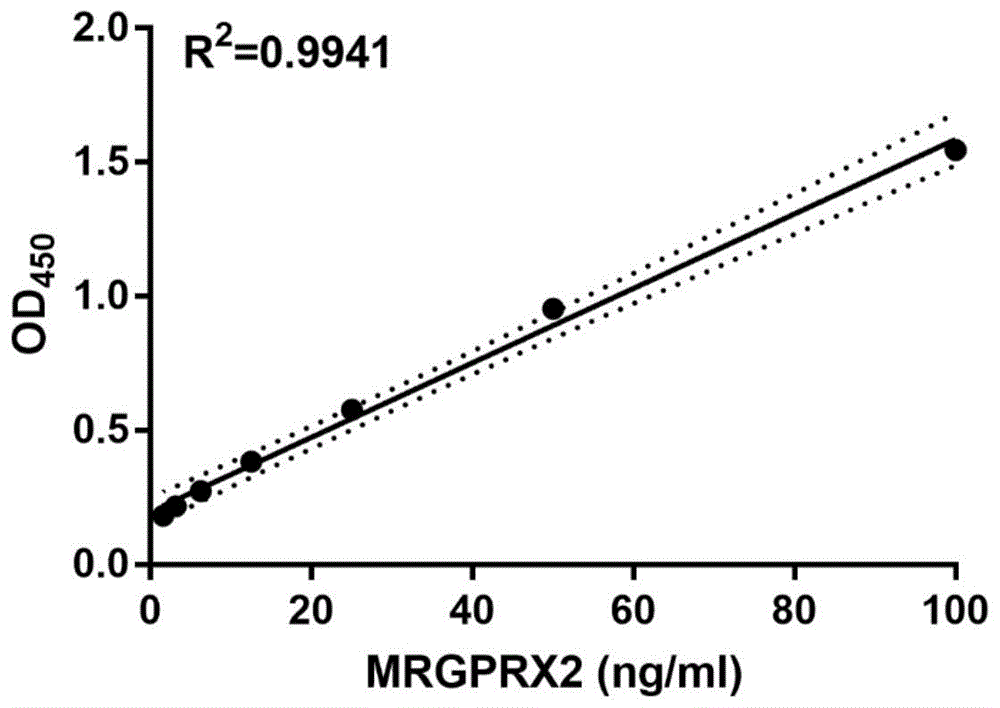
通过多肽合成,偶联,动物免疫,利用单克隆和多克隆技术制备单克隆抗体和多克隆抗体,利用间接ELISA法检测鼠单克隆抗体效价,结果显示抗体亲和多肽抗原能力较好;利用Dot blot方法检测兔多克隆抗体效价,结果兔多抗亲和多肽抗原的效价良好,能达1/200000。利用双抗体夹心法成功建立了以鼠单克隆抗体为包被抗体,生物素标记的兔多克隆抗体为检测抗体的双抗体夹心ELISA方法,所建立的方法的标准曲线R2值达到0.99以上。
下面结合附图对本发明做进一步详细描述:
实施例1类过敏反应特异性受体MRGPRX2蛋白抗原肽的合成
用DNAstar分析软件对人MRGPRX2氨基酸序列进行蛋白亲水性、序列的柔韧性、蛋白的表面可及性、蛋白的抗原指数等抗原表位进行预测分析,最终确定第134-144和286-330位为靶标,氨基酸序列为(134-144)IWYRCRRPRH和(286-330)RKQWRLQQPILKLALQRALQDIAEVDHSEGCFRQGTPEMSRSSLV。采用手动固相Fmoc法,从C端向N端方向合成,得到目标多肽粗品。利用反相高效液相色谱(HPLC)法根据不同多肽分子的疏水性差异将其分离的原理对目标多肽进行纯化。冻干溶剂后得到蓬松状态的多肽纯品,其化学结构由MALDI-TOF质谱进行表征,而其纯度则由分析型高效液相色谱仪(Agela C18-10×250mm,流速:每分钟1毫升)进行鉴定。
结果如图1所示,表明本发明所选取的第134-144和第286-330肽段位于类过敏反应特异性受体MRGPRX2蛋白抗原性和免疫原性及亲水性较强区段。
实施例2抗多肽鼠单克隆抗体的制备
取偶联的KLH-多肽制备成乳化针剂免疫,采取皮下分点注射的方式,在小鼠的背中线喷洒酒精,避开有免疫肿结的部位,一支针剂分四次注射,分别注射到4个不同的点。进行五次免疫后,小鼠尾静脉采血进行间接ELISA法检测抗血清效价。ELISA抗血清效价达到1:50000,说明免疫合格。选择效价最高的小鼠进行融合筛选,然后进行亚克隆,根据亚克隆的结果筛选纯单克隆细胞株。取单克隆细胞株的上清注射小鼠制备腹水,取腹水进行protein G亲和纯化,得到纯化的单克隆抗体。
实施例3抗体鉴定使用间接ELISA法检测单克隆抗体效价
1)酶标板准备:组装好酶标板后,准备进行抗原包被。
2)抗原稀释和包被:将配制好的抗原工作液加入凹形加样槽中,用300μL量程8孔移液器取100μL抗原工作液加入酶标板孔底部,加样完成后,盖上铝箔纸,37℃烘箱中温育2h或4℃过夜。
3)洗板:取出已包被好抗原的ELISA酶标板,倒扣去除孔内液体,再置于干净的吸水毛巾上排干;用排枪向每孔中加入200ml TBST至其装满但不溢出,整板加完静置3min后,将TBST甩出,甩3次,再置于干净的吸水毛巾上排干,每板拍6次(至无明显液体残留)。重复此组操作4次。
4)封闭:洗板完成后,用300μL量程8孔移液器向每孔加入200μL已配制好的封闭液(3%脱脂牛奶),盖上铝箔纸,37℃温箱静置1h。
5)一抗孵育:将稀释好的一抗(阳性血清和阴性血清)加入酶标板,37℃温箱静置孵育2h或4℃过夜。
6)洗板:操作同步骤3)。
7)二抗孵育:将二抗用TBST按1:5000稀释,然后用排枪每孔加100μL,37℃温箱静置孵育1h。
8)洗板:操作同步骤3)。
9)显色:显色前30min,将ELISA底物A、B从冰箱中取出,使其恢复至室温(室温过低时,需提前2h将底物拿出)。根据所需量将底物A、B按体积1:1配制,置于涡旋振荡仪上震荡10s混匀。ELISA板中每孔加入底物混合液100μL,加盖,静置反应5min。显色液体积=孔数×100μL+2mL。
10)终止:显色5min后,每孔中加入终止液100μL,加入终止液速度要快,以免样品过多,造成显色反应时间不一致。
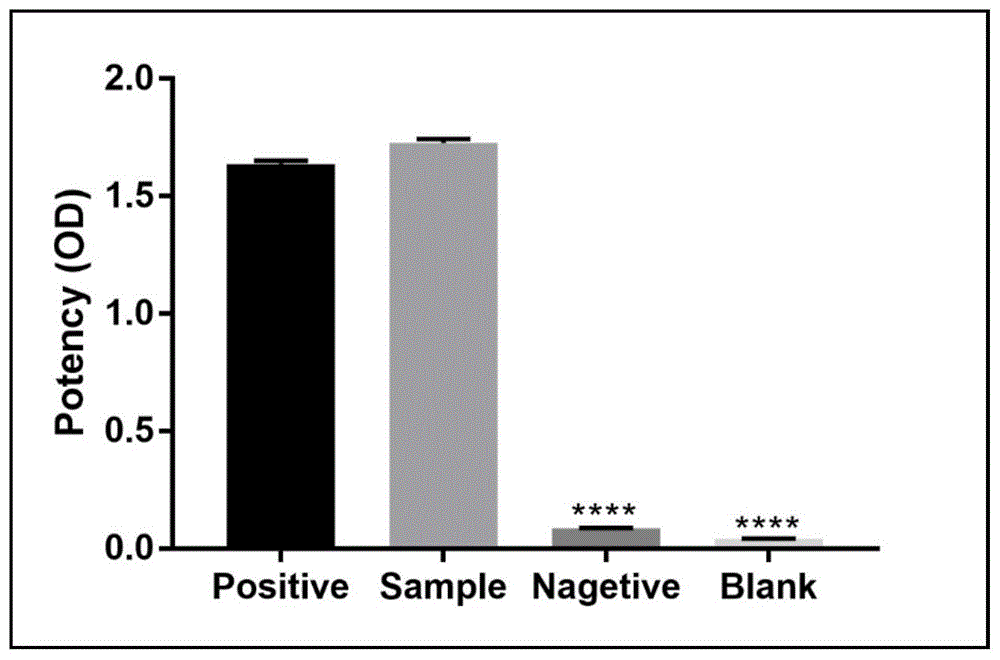
结果如图2所示,表明:ELISA检测制备的单克隆抗体和多肽抗原的效价较好,图中Positive表示阳性对照;Sample表示制备的单克隆抗体;Nagetive表示阴性对照;Blank表示空白对照。
实施例4抗多肽兔多克隆抗体的制备
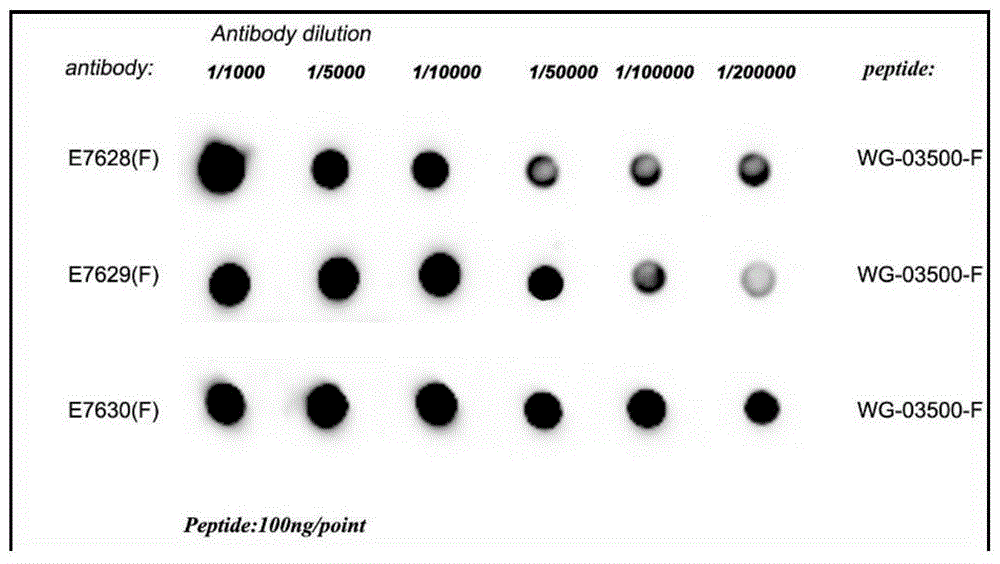
取偶联的KLH-多肽制备成乳化针剂免疫,采取皮下分点注射的方式,在新西兰兔的背中线喷洒酒精,避开有免疫肿结的部位,一支针剂分四次注射,分别注射到4个不同的点。进行五次免疫后,兔耳缘静脉采血进行间接Dot blot法检测抗兔血清效价。结果如图3所示,其中Dot blot检测制备的多克隆抗体的效价达1/200000(一般认为效价达1/50000以上为合格,说明本发明免疫成功)。对兔采用颈动脉放血收集抗体,并对兔多克隆抗体进行亲和纯化。
实施例5抗体鉴定:使用Dot blot法检测多克隆抗体效价
1)膜的准备:Dot blot检测采用NC膜,取NC膜裁成6.5cm宽长条,并在其上画长宽为1cm×1cm正方形小格(在膜上面的蓝色纸上画,画格时膜(白色)与蓝色纸必须完全重叠,让蓝色纸上的正方形小格能在膜上留下正确的划痕)。膜的两边各留出0.25cm宽的距离,按照一支抗体对应一条1cm×6cm长条,画出相应数量的正方形小格(画小格时,用力不能太小,要在膜上留下每个小格的划痕,但不能将膜划破)。
2)抗原包被:揭开膜上面的蓝色保护纸,用2.5μL移液器利用反向吸液的方式每小方格取50ng/μL相应多肽稀释液2μL,点在膜(白色)上1cm×1cm正方形小格中心,即多肽包被量为100ng。点样完成后,将NC膜及膜下面的蓝色保护纸一起放入37℃烘箱中30min。
3)封闭:向装有1cm2大小的小方格的每孔中加入1mL封闭液;按照划痕先剪下每条6个小方格(即1cm×6cm:A1-A6),再将6个小方格条剪成6个独立的小方格,将每个小方格按照编号顺序放入24孔板孔中(24孔板每条6孔,共4条,24孔板左右标记有A、B、C、D),膜中包被有多肽的一面朝上。封闭1h.
4)一抗孵育:封闭完成后,将封闭液倒掉,并在每孔中加入相应的一抗稀释液1mL,将24孔板置于摇床,一抗孵育2h。
5)二抗孵育
(1)洗膜
一抗孵育完成,将一抗倒在废液缸中,每孔中加入TBST 2mL洗膜5min,时间到后将TBST倒在废液缸中。洗膜重复5次。
(2)二抗稀释
洗膜期间,用TBST将与一抗相同物种来源的二抗以1:8000稀释为二抗工作液。洗膜完成后每孔中加入1mL二抗工作液,将其置于摇床,孵育1h。
(3)洗膜
二抗孵育完成,将二抗倒在废液缸中,每孔中加入TBST 2mL洗膜,5min,时间到后将TBST倒在废液缸中。洗膜重复5次。
6)显影。
结果如图3所示,制备的多克隆抗体效价较高,抗体滴度达1:200000,表明本发明成功制备了多克隆抗体。
实施例6双抗夹心法筛选ELISA配对(鼠单克隆和兔单抗)抗体
1)包被:包被液(CBS包被液:PH 9.66)包被鼠单克隆抗体100-400ng/孔,100μl/孔,4℃过夜或37℃2h;
2)洗板:洗涤液(PBST):300μl/孔,洗板3次;
3)封闭:封闭液(1%-5%BSA),200μl/孔,37℃2h;
4)洗板:洗涤液(PBST):300μL/孔,洗板3次;
5)夹心:稀释液(20×PBS PH 7.2)稀释MRGPRX2蛋白(ab 165129,abcam公司购买),100μl/孔,37℃2h;
6)洗板:洗涤液(PBST):300μL/孔,洗板3次;
7)检测:稀释液(20×PBS PH 7.2)稀释兔多克隆抗体:50-400ng/孔,100μl/孔,37℃1h;
8)洗板:洗涤液(PBST):300μL/孔,洗板3次;
9)酶标:稀释液(20×PBS PH 7.2)稀释HRP-链霉亲和素(#A21000,Abbkine公司购买),1:500稀释,37℃30min;
10)洗板:洗涤液(PBST):300μL/孔,洗板3次;
11)显色:单组份显色液(PR1200,Solarbio公司购买),100μl/孔,37℃显色10min。
12)终止:终止液(2mol/L H2SO4),50μl/孔。
结果如图4所示,图4是建立双抗夹心法的标准曲线,R2值达到0.9941以上,线性良好,线性范围0-100ng/ml。
综上所述,本发明的试验结果:
1.多肽与载体的偶联效率:Ellman(DTNB)试剂法和BCA法测定的偶联效率大致相符,大于90%。
2.抗体效价:小鼠的抗血清效价均在1:32000以上;三只新西兰兔的抗血清效价均在1:100000以上。
3.抗体亲和力:亲和力较强。
4.配对抗体:成功配对出应用双抗夹心试剂盒的配对抗体,其中鼠单克隆抗体做包被抗体,兔多克隆抗体做检测抗体。通过条件优化,制备出线性良好的标准曲线,R2值达到0.99以上。
5.临床应用:结果如图5所示,利用建立的双抗体夹心ELISA方法检测临床上确定发生了荨麻疹的患者和正常体检人群的血样,结果表明,具有显著差异性(p<0.05)。
综上所述,本发明利用生物信息学方法预测MRGPRX2的优势抗原表位,筛选带有优势抗原表位的多肽序列;利用手动固相Fmoc法合成多肽序列,并利用分析型高效液相色谱仪分析了多肽的纯度;最后通过单克隆技术和多克隆技术制备出鼠单克隆抗体和兔多克隆抗体,成功制备了双抗夹心ELISA试剂盒,验证了建立的方法在临床中的应用,为进一步研制患者在用药过程中发生类过敏反应风险的MRGPRX2临床检测试剂盒提供科研思路,对临床上指导用药的安全性具有重要意义。
以上内容仅为说明本发明的技术思想,不能以此限定本发明的保护范围,凡是按照本发明提出的技术思想,在技术方案基础上所做的任何改动,均落入本发明权利要求书的保护范围之内。
序列表
<120> 一种用于制备类过敏反应的双抗夹心试剂盒配对抗体的多肽及其应用
<140> 西安交通大学
<160> 2
<170> SIPOSequenceListing 1.0
<210> 1
<211> 10
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 1
Ile Trp Tyr Arg Cys Arg Arg Pro Arg His
1 5 10
<210> 2
<211> 45
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 2
Arg Lys Gln Trp Arg Leu Gln Gln Pro Ile Leu Lys Leu Ala Leu Gln
1 5 10 15
Arg Ala Leu Gln Asp Ile Ala Glu Val Asp His Ser Glu Gly Cys Phe
20 25 30
Arg Gln Gly Thr Pro Glu Met Ser Arg Ser Ser Leu Val
35 40 45



评论
全部评论
共{{commentCount}}条{{rs.Msg_Content}}