本发明公开了一种促进TFEB核转位的短肽及基于其的线性短肽和其减轻脑缺血损伤的应用,属于生物医药技术领域。本发明公开的短肽是一种由TFEB蛋白与14‑3‑3蛋白结合的功能区域融合而成的短肽,其核苷酸序列如SEQ.ID.NO.1所示。本发明还公开了保护上述短肽的线性短肽,由穿膜肽与上述短肽融合而成。本发明通过实验验证了合成的融合肽能够调控TFEB核转位,促进CMA减轻细胞损伤。因此,公开了其减轻神经元死亡以及改善脑缺血损伤的治疗新靶点的应用。
1.一种促进TFEB蛋白核转位的短肽,其特征在于,该短肽是基于TFEB蛋白与14-3-3蛋白结合的功能区域合成的短肽,该短肽的氨基酸序列如SEQ.ID.NO.1所示。
2.含有权利要求1所述的促进TFEB蛋白核转位的线性短肽,其特征在于该线性短肽是由促进TFEB蛋白核转位的短肽与穿膜肽融合而成。
3.如权利要求2所述的线性短肽,其特征在于,所述穿膜肽选择TAT,则融合而成的线性短肽的序列如SEQ.ID.NO.2所示。
4.如权利要求2所述的线性短肽,其特征在于,所述穿膜肽选择SynB3,则融合而成的线性短肽的序列如SEQ.ID.NO.4所示。
5.权利要求2~4中任意一项所述的线性短肽在制备治疗脑卒中及神经细胞损伤药物中的应用。
6.如权利要求5所述的应用,其特征在于,所述的药物为促进TFEB核转位调节细胞功能发挥的药物。
7.如权利要求6所述的应用,其特征在于,所述的药物为通过竞争性结合14-3-3蛋白促进TFEB蛋白核转位增强分子伴侣介导的自噬的药物。
8.如权利要求5所述的应用,其特征在于,所述的药物为减轻脑缺血损伤、改善神经功能的药物。
9.权利要求2~4中任意一项所述的线性短肽在制备退行性神经系统疾病的药物中的应用。
10.如权利要求5或9所述的应用,其特征在于,所述的药物能够通过静脉注射给药,自由透过血脑屏障。
技术领域
本发明属于生物医药技术领域,涉及促进TFEB核转位增强分子伴侣介导的自噬(Chaperone-mediated autophagy,CMA)减轻神经损伤的短肽及其应用,具体涉及一种促进TFEB核转位的短肽及基于其的线性短肽及其减轻脑缺血损伤的应用。
背景技术
脑卒中严重威胁人类生命健康,全球每年约有1690万新发卒中患者,590万病人死于卒中相关性疾病;另有3300万卒中病人需要长期治疗、照顾,给社会和家庭带来了沉重的负担(Lancet,2017)。tPA(Tissue plasminogen activator)是目前美国FDA批准治疗缺血性卒中的唯一药物,但其治疗时间窗短、增加出血风险,仅有4-7%的患者从中受益。因此,进一步阐明卒中的病理机制,寻找可靠的药物靶点,对开发卒中的干预措施和治疗药物具有重要意义。
自噬(Autophagy)的发现,是人们认识细胞存活的一次飞跃,开创了机体维持内环境稳态、减少细胞死亡的新纪元,也为缺血性脑卒中的防治提供了新思路。大量研究证实,多种预处理方式及雷帕霉素可通过促进自噬减轻脑缺血损伤。申请者研究团队发现,高压氧(Hyperbaric oxygen,HBO)预处理可通过增强神经元自噬减轻脑缺血损伤;最新研究也证实,上调星形胶质细胞的自噬流水平,可减少脑缺血后神经。但迄今为止,自噬加重还是减轻脑缺血损伤仍存争议(Progress in Neurobiology,2018);相关研究也指出用3-MA或Beclin-1 RNAi抑制自噬可减轻脑缺血后神经损伤。自噬究竟加重还是减轻脑缺血损伤,重新审视“自噬影响脑缺血损伤预后的核心机制”迫在眉睫。
在近期研究中,申请人课题组利用iTRAQ高通量蛋白质组学技术筛选出内源性脑保护作用的效应分子Cystatin C;并通过构建基因敲除大鼠验证,发现Cystatin C可通过保护自噬的最关键部分——溶酶体,从而减轻脑缺血损伤(ZP Fang et al.Stroke,2017)。在探索Cystatin C通过哪些途径及下游信号分子保护溶酶体的研究中,我们发现在Cystatin C基因敲除大鼠脑内,调控自噬-溶酶体通路的关键因子——TranscriptionFactor EB(TFEB)表达显著降低。同时,我们意外地发现TFEB降低情况下,溶酶体膜的重要成分、也是调节分子伴侣介导自噬(Chaperone-mediated autophagy,CMA)的关键蛋白——Lysosome-associated membrane protein 2A(LAMP-2A)显著减少。这一新发现促使我们思索自噬调节细胞存活的核心机制是什么。根据细胞内物质传送至溶酶体的具体方式,自噬可分为大自噬(Macroautophagy)、小自噬(Microautophagy)以及分子伴侣介导的自噬(CMA)。以往研究多集中于大自噬,3-MA或Beclin-1 RNAi等干预措施也只能调节大自噬。但大自噬降解底物无选择性——既可降解受损蛋白、细胞器;也可由于自噬过度,过多地降解细胞自身正常成分,造成细胞死亡。这可能是导致自噬影响脑缺血损伤预后出现争议性结果的重要原因。反观CMA,是一种具有靶向降解错误折叠蛋白的自噬类型。调控CMA是否才是减轻脑缺血损伤的关键,自噬-溶酶体通路的关键调节因子TFEB是否可以调控CMA减轻脑缺血损伤,经过检索发现,目前并没有这方面的任何研究报道。
发明内容
为了克服上述现有技术的缺点,本发明的目的在于提供一种促进TFEB核转位的短肽及基于其的线性短肽和其减轻脑缺血损伤的应用。
为了达到上述目的,本发明采用以下技术方案予以实现:
本发明公开了一种促进TFEB蛋白核转位的短肽,该短肽是基于TFEB蛋白与14-3-3蛋白结合的功能区域合成的短肽,该短肽的氨基酸序列如SEQ.ID.NO.1所示。
本发明还公开了含有上述的促进TFEB蛋白核转位的短肽的线性短肽,该线性短肽是由促进TFEB蛋白核转位的短肽与穿膜肽融合而成。
优选地,所述穿膜肽选择TAT,则融合而成的线性短肽的序列如SEQ.ID.NO.2所示。
优选地,所述穿膜肽选择SynB3,则融合而成的线性短肽的序列如SEQ.ID.NO.4所示。
本发明还公开了上述的线性短肽在制备治疗脑卒中及神经细胞损伤药物中的应用。
优选地,所述的药物为促进TFEB核转位调节细胞功能发挥的药物。
优选地,所述的药物为通过竞争性结合14-3-3蛋白促进TFEB蛋白核转位增强分子伴侣介导的自噬的药物。
优选地,所述的药物为减轻脑缺血损伤、改善神经功能的药物。
本发明还公开了上述的线性短肽在制备退行性神经系统疾病的药物中的应用。
优选地,所述的药物能够通过静脉注射给药,自由透过血脑屏障。
与现有技术相比,本发明具有以下有益效果:
本发明首次公开了一种能够促进TFEB蛋白核转位的短肽,该短肽由TFEB蛋白与14-3-3蛋白结合的功能区域融合而成。传统大自噬在降解底物时无选择性,在清除受损蛋白及细胞器的同时,也会降解自身正常成分。而分子伴侣介导的自噬(CMA)可以保留细胞中的正常蛋白,清除因氧化性损伤造成的无功能蛋白;这种更具选择性的蛋白降解途径,更有助于维持细胞内环境的稳定性。将研究目标从传统大自噬转向CMA,成为调控自噬减轻脑缺血损伤的突破口。经过试验验证,本发明短肽Tat-S211能够有效促进TFEB核转位,增加CMA相关蛋白的表达,同时减轻神经元及缺血性卒中后的神经损伤。
进一步地,本发明的上述短肽能够与穿膜肽融合成一条线性短肽,能够减少目的肽的分子量,增加穿膜肽的穿膜效率,以保证其能够透过血脑屏障,进入细胞内。
更进一步地,为了能够快速、特异地调节TFEB转录活性,本发明合成的线性短肽(选择穿膜肽TAT)TAT-S211只有21个氨基酸,TAT-S211可明显促进神经元TFEB核转位,并增加CMA的关键单位LAMP-2A和Hsc70的表达,显著减少OGD后细胞死亡。该线性短肽不仅减少了机体的免疫排斥反应,其合成成本也较低,将其作为生物活性分子,应用于制备脑卒中药物,前景十分广阔。
附图说明
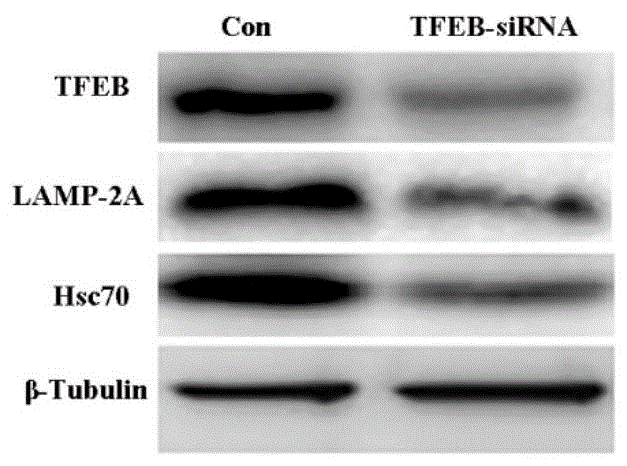
图1A为siRNA干扰原代神经元TFEB表达后,CMA标记蛋白表达的Western blot图。
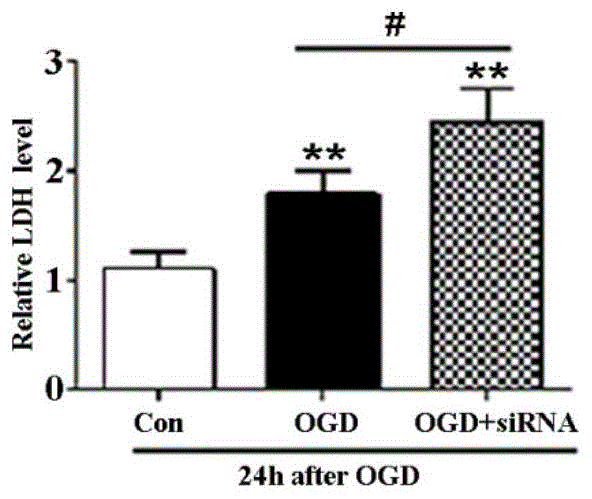
图1B为siRNA抑制TFEB核转位后OGD神经元的损伤图。
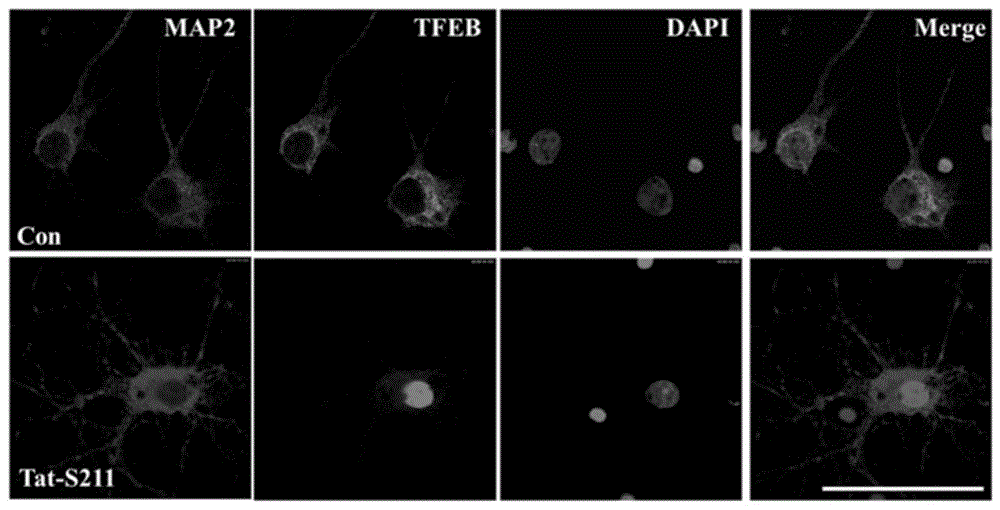
图2为本发明的短肽Tat-S211促进TFEB核转位的免疫荧光图。
图3A为本发明的短肽Tat-S211促进CMA标记蛋白表达的Western blot图。
图3B为Tat-S211减轻神经元OGD损伤的效果图。
图4为MCAO小鼠神经元TFEB核转位减少的免疫荧光图。
图5为Tat-S211促进MCAO小鼠TFEB核转位效果的Western blot图;其中,A显示对细胞浆里含量无影响;B显示增加细胞核里蛋白含量。
图6为Tat-S211减轻小鼠脑缺血损伤的效果图。其中,A为Tat-S211减轻小鼠脑缺血后神经功能损伤的效果图;B为Tat-S211减轻小鼠脑缺血后脑梗死面积的效果图;C为Tat-S211减轻小鼠脑梗死面积效果的统计图。
图7为SynB3-S211减轻神经元OGD损伤的效果图。
图8SynB3-S211减轻小鼠脑缺血损伤的效果图。其中,A为SynB3-S211减轻小鼠脑缺血后神经功能损伤的效果图;B为SynB3-S211减轻小鼠脑缺血后脑梗死面积的效果图;C为SynB3-S211减轻小鼠脑梗死面积效果的统计图。
具体实施方式
为了使本技术领域的人员更好地理解本发明方案,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分的实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都应当属于本发明保护的范围。
需要说明的是,本发明的说明书和权利要求书及上述附图中的术语“第一”、“第二”等是用于区别类似的对象,而不必用于描述特定的顺序或先后次序。应该理解这样使用的数据在适当情况下可以互换,以便这里描述的本发明的实施例能够以除了在这里图示或描述的那些以外的顺序实施。此外,术语“包括”和“具有”以及他们的任何变形,意图在于覆盖不排他的包含,例如,包含了一系列步骤或单元的过程、方法、系统、产品或设备不必限于清楚地列出的那些步骤或单元,而是可包括没有清楚地列出的或对于这些过程、方法、产品或设备固有的其它步骤或单元。
下面结合附图对本发明做进一步详细描述:
1、化学合成TAT-S211短肽
设计目的和要求:为减少目的肽的分子量、增加穿膜肽的穿膜效率,选择从TFEB蛋白上截取的一部分序列作为结合肽,所截取的氨基酸序列同时还要能够保持较高的结合14-3-3蛋白的能力,要求其可作为一种假底物妨碍TFEB与14-3-3结合,从而可以促进TFEB入核,进而促进CMA减轻细胞损伤。
本实施例所用穿膜肽以穿膜肽TAT为例,由于其仅仅只有11个氨基酸,氨基酸序列如SEQ.ID.NO.3所示,因此其可以有效地将蛋白、多肽等生物大分子通过无受体介导、无耗能的方式,导入细胞内,且在一定浓度范围内不会造成细胞损伤。
本发明的线性短肽TAT-S211委托上海吉尔生物科技有限公司合成,其氨基酸序列如SEQ.ID.NO.2所示;其中,TFEB功能区域S211氨基酸序列为:VTSSSCPADL,氨基酸序列如SEQ.ID.NO.1所示;TAT氨基酸序列为:YGRKKRRQRRR,氨基酸序列如SEQ.ID.NO.3所示。
2、验证短肽TAT-CIRP神经保护效应的实验方法
2.1实验动物
SPF级C57BL/6鼠,雄性,8-10周龄,体重20~25g,健康雌性C57孕鼠,孕16天。由第四军医大学实验动物中心购买。动物培养环境均为SPF级,12小时昼/夜节律调节,自由饮食。实验过程严格遵照第四军医大学动物实验指南。
2.2.设计合成短肽
将按以下氨基酸序列设计好的短肽,委托上海吉尔生物科技有限公司进行合成。TAT:YGRKKRRQRRR.(如SEQ.ID.NO.3所示)
TAT-S211:YGRKKRRQRRR-VTSSSCPADL。(如SEQ.ID.NO.2所示)
2.3原代神经元的培养
将30μg/ml的L-多聚赖氨酸,加入12孔及24孔的细胞培养板中(0.5毫升),用无菌锡纸包好,放置于超净台中,室温过夜孵育(包被)。次日,用真空吸引泵吸去多聚赖氨酸,并用高温高压消毒后的双蒸水冲洗3遍。
孕16天C57BL/6小鼠深度麻醉后,将孕鼠仰卧,放置于无菌托盘中。并依次用酒精、碘伏消毒孕鼠腹部。切开腹部皮肤,换用新的无菌剪刀剪开腹肌及腹膜。用剪刀将胚胎剪下,放入预冷的D-Hanks液中。换新的无菌眼科剪,剪下胎鼠头部,放入于新的D-Hanks液中。在显微镜下,用显微镊仔细分离脑膜、血管。将皮层脑组织取下,放于新的D-Hanks液,并充分剪碎。将2毫升0.25%胰蛋白酶加入剪碎组织中,并在培养箱中(37℃、5%CO2)消化10分钟。加入含血清的培养基终止胰酶消化。用移液器将终止消化后的组织液转移至15毫升离心管中,以1000转/分钟转速,离心10分钟。用移液器小心吸出上清液,并往离心管中加入培养基(含20%胎牛血清)。用滴管将细胞充分吹散,获得单细胞悬液。吸出10微升细胞悬液,稀释100倍后,用玻璃计数板计数。根据细胞总数,加入培养基,充分混匀,接种至12孔板及24孔板。接种密度为12孔板:3.0*105,24孔板:2.0*105。置于37℃、5%CO2培养箱中培养。3天后半量换液,以后每3天1/3量换液一次。
神经元损伤采用氧糖剥夺(Oxygen glucose deprivation,OGD),通过检测释放到培养基中的乳酸脱氢酶(lactate dehydrogenase,LDH)测定细胞死亡。
2.4构建小鼠局灶性脑缺血模型(MCAO)
用2.5%异氟醚将小鼠诱导麻醉后,以1.5%异氟醚维持,并使动物在手术过程中能够自主呼吸。将小鼠固定,使其仰卧于恒温板上(恒温板温度为37℃),监测肛温,使体温维持在37.0±0.5℃,术前、术中及术后利用激光多普勒血流仪,监测大脑中动脉体表投射区血流。用碘伏在小鼠颈部消毒后,用手术刀于颈正中皮肤切一小口,充分暴露并小心分离右侧颈总动脉,颈外动脉以及颈内动脉。用3号慕丝线,在颈总动脉近心端打一活结,暂时阻断颈总动脉血流;将右侧颈外动脉远心端结扎,并在颈外动脉用注射器扎一小口。将长15毫米线栓(深圳瑞沃德公司)沿颈外动脉插入。用显微镊将线栓向前推送,推进大约8到9毫米(距颈内、外动脉分叉口),当有轻微阻力感时,表明线栓抵已达大脑中动脉起始点,停止插入。根据脑血流检测仪结果,将线栓阻闭后,大脑中动脉血流值降低到低于阻闭前30%水平,视为建模有效,否则排除。将切口缝合,并将小鼠放至恒温箱内,使其体温维持于37.0±0.5℃之间。阻断血流1小时后,用异氟醚将小鼠重新麻醉,重新打开切口,缓慢拔出线栓,恢复灌注,10分钟内,血流恢复至基础值的70%以上视为成功模型,否则排除。缝合皮肤,将小鼠置于保温箱,等待小鼠自然苏醒。假手术组小鼠只进行手术操作,不插入线栓。术后30min分别通过尾静脉给Tat-S211(20mg/kg)、对照组给生理盐水。
2.5脑缺血损伤神经功能学评估
卒中模型成功后,根据实验计划,在相应时间点评分。评分由两个不了解实验分组的研究人员,参考Longa评分法进行评分。
2.6TTC染色测定脑梗死体积
小鼠深麻醉后,用剪刀将小鼠头部迅速取下,迅速剥除颅骨,取出大脑,放入4℃冰箱冷却10分钟。然后将大脑放入脑槽,用刀片将大脑均匀切成1mm厚(冠状切面)。将1mm厚的脑片转移至预热(37℃)的2%TTC溶液中。10分钟后,将TTC染液回收,用4%多聚甲醛将染好的脑片固定24h。采用数码相机拍照,将脑片图像导入计算机,用Adobe Photoshop cc软件分析脑梗死容积。为减少缺血侧脑组织水肿对梗死体积的影响,本实验用梗死体积百分比表示梗死程度:梗死容积百分比=(对侧大脑半球体积-梗死侧正常脑组织体积)/对侧大脑半球体积*100%。
2.7Western Blot及免疫荧光按常规方法进行。
2.8统计学处理
本研究采用SPSS19.0统计软件对数据进行分析。计量资料如梗死面积百分比、蛋白表达相对含量用平均值±标准差(mean±SD)表示。计量资料两组间比较用Student’s t检验;多组、组间比较采用单因素方差分析(One-way ANOVA),根据实验需求用Dunnett检验或者Bonferroni检验法。神经行为学评分用中位数表示。两组间比较采用非参数检验(Mann-Whitney U),多组组间比较采用Kruskal-Wallis H检验进行两两比较后,并用Bonferroni法进行校正。P值小于0.05,认为组间差异有统计学意义。
3、实验结果
3.1下调TFEB可抑制CMA,加剧神经元死亡(In vitro)
通过培养小鼠原代神经元,并利用离体原代神经元OGD模型模拟脑缺血损伤。研究结果发现OGD后,利用TFEB的siRNA干扰TFEB表达,可使CMA的关键蛋白LAMP-2A和Hsc70表达减少,结果参见图1A和图1B,结果表明siRNA干扰原代神经元TFEB表达,抑制CMA从而加重OGD后神经元死亡,其中,图1A图显示TFEB-siRNA抑制TFEB表达的同时,减少神经元内LAMP-2A和Hsc70的含量;图1B图显示,TFEB-siRNA增加OGD后神经元释放LDH,明显加剧OGD后神经元死亡。
3.2Tat-S211可促进TFEB入核,促进CMA的关键蛋白LAMP-2A和Hsc70表达(Invitro)
由于siRNA在动物实验及临床应用中的局限性,为了能快速特异地干预TFEB转录活性,我们根据TFEB蛋白的生物学功能,自主设计合成了能透过血脑屏障并增加TFEB转录活性的短肽Tat-S211(21个氨基酸,Tat-S211:YGRKKRRQRRR-VTSSSCPADL),由于该短肽包含TFEB的第211位丝氨酸磷酸化位点,因此mTORC1能磷酸化该短肽,从而与TFEB竞争性结合14-3-3(该蛋白能将TFEB铆定于胞浆中),从而减少TFEB与14-3-3的结合。参见图2,免疫荧光结果显示,在体外培养的原代神经元中,Tat-S211能明显促进TFEB进入细胞核。参见图3A和图3B,其中,图3A的Western blot结果表明,在原代培养的神经元中加入Tat-S211(10μM)后,Tat-S211可显著增加CMA的标记蛋白Hsc70以及LAMP2A的蛋白含量;图3B的LDH结果显示,OGD后神经元释放大量LDH,OGD后神经元死亡率显著增加;给予Tat-S211后,神经元释放LDH量显著减少,说明Tat-S211可以显著减少OGD后细胞死亡,即显著抑制神经元死亡。
3.3脑缺血后半暗带神经元TFEB细胞核分布明显减少,Tat-S211促进脑组织中TFEB核转位(In vivo)
初步的在体实验证实,脑缺血再灌注后12h,神经元中TFEB在细胞核含量显著减少,如图4所示,图4中,绿色:NueN标记神经元;红色:TFEB,于脑缺血后12h细胞核中表达显著减少。参见图5,图5中A和B显示,尾静脉注射Tat-S211(10mg/kg)可显著增加C57小鼠脑组织中细胞核TFEB的含量,增加其转录活性。
3.4TAT-S211显著减轻缺血性神经损伤
为了证实促进TFEB核转位是减轻缺血性卒中神经损伤的重要因素,本发明于缺血再灌注损伤后30min,分别静脉给予小鼠生理盐水、Tat-S211进行治疗(20mg/kg,i.v.),72小时后评估其神经功能及采用TTC染色计算梗死体积。如图6所示,图6中A图所示,与生理盐水组相比,Tat-S211治疗组小鼠的神经功能障碍评分显著下降。TTC染色显示,在Tat-S211治疗组,梗死容积明显减少(图6中B,C)。
综合以上结果,本发明首次证实促进TFEB核转位可显著增强CMA水平。而本发明以TFEB为干预靶点而合成的短肽TAT-S211能够显著减轻神经元氧糖剥夺损伤,并改善缺血性脑卒中的预后。
此外,本发明还选择了穿膜肽SynB3,氨基酸序列为RRLSYSRRRF,序列如SEQ.ID.NO.5所示;其与S211序列融合为SynB3-S211,氨基酸序列为RRLSYSRRRF-VTSSSCPADL,序列如SEQ.ID.NO.4所示。如图7所示,单独的穿膜肽SynB3不能减轻OGD后神经元死亡,而SynB3-S211可显著减轻OGD后神经元死亡。在体实验进一步证实,如图8中,A、B和C所示单独的穿膜肽SynB3不能减轻脑缺血后神功能损伤,而融合后的SynB3-S211显著减轻缺血后神经功能损伤,减小脑梗死面积。
以上内容仅为说明本发明的技术思想,不能以此限定本发明的保护范围,凡是按照本发明提出的技术思想,在技术方案基础上所做的任何改动,均落入本发明权利要求书的保护范围之内。
序列表
<110> 中国人民解放军第四军医大学
<120> 一种促进TFEB核转位的短肽及基于其的线性短肽和其减轻脑缺血损伤的应用
<160> 5
<170> SIPOSequenceListing 1.0
<210> 1
<211> 10
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 1
Val Thr Ser Ser Ser Cys Pro Ala Asp Leu
1 5 10
<210> 2
<211> 21
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 2
Tyr Gly Arg Lys Lys Arg Arg Gln Arg Arg Arg Val Thr Ser Ser Ser
1 5 10 15
Cys Pro Ala Asp Leu
20
<210> 3
<211> 11
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 3
Tyr Gly Arg Lys Lys Arg Arg Gln Arg Arg Arg
1 5 10
<210> 4
<211> 20
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 4
Arg Arg Leu Ser Tyr Ser Arg Arg Arg Phe Val Thr Ser Ser Ser Cys
1 5 10 15
Pro Ala Asp Leu
20
<210> 5
<211> 10
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 5
Arg Arg Leu Ser Tyr Ser Arg Arg Arg Phe
1 5 10




评论
全部评论
共{{commentCount}}条{{rs.Msg_Content}}