本发明公开了一种用于比率荧光检测的固定化酶反应器及其制备方法,该固定化酶反应器是在表面胺基化的介孔二氧化硅纳米颗粒孔道内装载荧光素后,在其表面修饰量子点,然后包覆一层ZIF‑8,形成核壳结构复合纳米粒子,再以该核壳结构复合纳米粒子为载体固定化酶。本发明有效的将荧光素用量子点封装在介孔二氧化硅孔隙中,形成了比率荧光体系,并以ZIF‑8作为过渡层将比率荧光体系保护在其中,且其表面未饱和Zn可以有效的修饰生物酶,形成固定化酶反应器。本发明固定化酶反应器制备方法简单,可根据固载酶的不同,基于比率荧光检测不同的酶解底物,且用于实际样品检测时无需加入额外试剂,具有检测成本低、快速简便、灵敏度高、准确性和特异性好等优点。
1.一种用于比率荧光检测的固定化酶反应器,其特征在于:在表面胺基化的介孔二氧化硅纳米颗粒孔道内装载荧光素后,在其表面修饰量子点,其中荧光素和量子点在同一激发波长下必须同时出现两个发射峰;然后包覆一层ZIF-8,形成核壳结构的复合纳米粒子,最后以该核壳结构复合纳米粒子为载体固定化酶,从而得到用于比率荧光检测的固定化酶反应器。
2.根据权利要求1所述的用于比率荧光检测的固定化酶反应器,其特征在于:所述表面胺基化的介孔二氧化硅纳米颗粒的粒径为50~100nm,其孔道直径小于3nm。
3.根据权利要求1所述的用于比率荧光检测的固定化酶反应器,其特征在于:所述量子点为CdTe量子点、碳量子点、硅量子点中的任意一种,其粒径为3~10nm。
4.根据权利要求3所述的用于比率荧光检测的固定化酶反应器,其特征在于:所述的荧光素为5-氨基荧光素、异硫氰酸荧光素、羟基荧光素、四氯荧光素中的任意一种。
5.根据权利要求1所述的用于比率荧光检测的固定化酶反应器,其特征在于:所述的酶为胆固醇氧化酶、葡萄糖氧化酶、尿素氧化酶中的任意一种。
6.一种权利要求1所述的固定化酶反应器的制备方法,其特征在于它由下述步骤组成:(1)将表面胺基化的介孔二氧化硅纳米颗粒分散于PBS缓冲液中,并加入荧光素,常温超声分散均匀后搅拌24小时,离心分离,得到装载荧光素的介孔二氧化硅纳米颗粒;(2)将量子点和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐分散于PBS缓冲液中,常温搅拌20~30分钟,然后加入装载荧光素的介孔二氧化硅纳米颗粒,常温孵化3~4小时,用PBS缓冲液离心洗涤,得到双荧光的介孔二氧化硅纳米颗粒;(3)将步骤(2)得到的双荧光的介孔二氧化硅纳米颗粒分散于去离子水中,并加入十六烷基三甲基溴化铵,常温搅拌20~30分钟,用甲醇离心洗涤,所得沉淀超声分散于甲醇中,并加入Zn(NO3)2·6H2O和二甲基咪唑,50℃下静置2~3小时,用甲醇离心洗涤,得到双荧光的核壳结构介孔二氧化硅@ZIF-8复合纳米粒子;(4)将双荧光的核壳结构介孔二氧化硅@ZIF-8复合纳米粒子分散于PBS缓冲液中,然后加入酶,在3~5℃下孵育12~16小时,用PBS缓冲液离心洗涤,得到固载酶的核壳结构复合纳米粒子,即用于比率荧光检测的固定化酶反应器。
7.根据权利要求6所述的固定化酶反应器的制备方法,其特征在于:在步骤(3)中,所述Zn(NO3)2·6H2O和二甲基咪唑摩尔比为1:1。
8.根据权利要求6所述的固定化酶反应器的制备方法,其特征在于:所述PBS缓冲液的pH=7.4。
技术领域
本发明属于生物传感技术领域,具体涉及一种用于比率荧光检测的固定化酶反应器及其制备方法。
背景技术
胆固醇和脂肪酸酯是神经和脑细胞中重要的化合物,它们是其他生物材料的前体,如胆酸和类固醇激素。没有胆固醇,脑细胞就不能发送信息给我们身体的器官。胆甾醇是类固醇激素、维生素D和胆汁的前体,然而,保持人体胆固醇水平在一定范围内是至关重要的。在正常情况下,人体血清中的胆固醇浓度应低于200mg·dL-1,任何高于240mg·dL-1的血清水平都表明血液中胆固醇含量过高。高胆固醇水平会对血管造成损害,导致心血管疾病、动脉硬化、心脏病、中风、冠状动脉疾病、脑血栓和其他疾病。然而,低浓度的胆固醇会导致低胆固醇血症,这可能导致出血性中风。迄今为止,已经提出了许多先进的生物传感器设计方案选择性检测血液中的单一分析物用于几种疾病诊断和治疗。有几种方法已经用来检测胆固醇,如电化学方法、薄层色谱法、高效液相色谱法、光学法、极谱法、比色法、光子晶体和荧光分析法。在这些方法中,荧光分析法应用于胆固醇检测化验具有简单、快速、灵敏度、时空分辨率、线性范围宽等优点。
为了获得更准确的读数,比率荧光测定法已经引起了相当大的关注。通过对两种波长荧光强度的变化进行检测,对环境条件的内建校正,可以通过测量荧光强度的变化来检测分析物,从而达到提高灵敏度和准确度的目标。量子点(QDs)由于其宽的吸收和窄的,尺寸可调的发射而优于有机荧光团,这使得它可以通过单波长的激发实现不同波段的辐射。因此,QDs具有五彩荧光体系构建的优越。在过去的几年里,基于双色QDs系统的荧光纳米探针已经成功地开发出了用于视觉和灵敏的检测金属离子。
近年来,介孔二氧化硅纳米颗粒(MSNs)由于其独特的孔径、大容量、化学和热稳定性以及在水溶液中的可分散性,被认为是一种可控释放的智能载体材料。此外,具有高表面硅烷醇的MSNs有利于各种表面反应和生物分子的结合(Zhang,P.;Cheng,F.;Zhou,R.;Cao,J.;Li,J.;Burda,C.;Min,Q.;Zhu,J.Angew.Chem.,Int.Ed.2014,53,2371–2375.)。另一方面,由金属离子(或团簇)和有机桥接体组成的金属-有机框架(MOFs)由于其高孔隙体积、高比表面积和高度有序的晶体多孔网络而引起了相当多的研究关注(Cook,T.R.;Zheng,Y.R.;Stang,P.J.Chem.Rev.2013,113,734–777.)。最近,通过将纳米粒子(NPs)封装在MOFs中,形成了核壳NP@MOF纳米复合材料,进一步扩展了MOFs的潜在应用。在MOFs中加入NPs是一种非常有趣的现象,因为它能让MOFs和某些类型的NPs具有新的化学和物理特性,如更高的表面积、可调的孔隙度和光致发光特性(Wang,K.;Li,N.;Zhang,J.;Zhang,Z.;Dang,F.Biosen.Bioelectron.2017,87,339–344)。
发明内容
本发明所要解决的技术问题在于提供一种用于比率荧光检测的固定化酶反应器,以及该固定化酶反应器的制备方法。
解决上述技术问题所采用的固定化酶反应器是在表面胺基化的介孔二氧化硅纳米颗粒孔道内装载荧光素后,在其表面修饰量子点,其中荧光素和量子点在同一激发波长下必须同时出现两个发射峰;然后包覆一层ZIF-8,形成核壳结构的复合纳米粒子,最后以该核壳结构复合纳米粒子为载体固定化酶,从而得到用于比率荧光检测的固定化酶反应器。
上述表面胺基化的介孔二氧化硅纳米颗粒的粒径为50~100nm,其孔道直径小于3nm,根据文献“Sreejith,S.;Ma,X.;Zhao,Y.J.Am.Chem.Soc.2012,134,17346-17349”中公开的方法制备而成。
上述的量子点为CdTe量子点、碳量子点、硅量子点中的任意一种,其粒径为3~10nm。
上述的荧光素为5-氨基荧光素、异硫氰酸荧光素、羟基荧光素、四氯荧光素中的任意一种。
上述的酶为胆固醇氧化酶、葡萄糖氧化酶、尿素氧化酶中的任意一种。
本发明固定化酶反应器的制备方法如下:
1、将表面胺基化的介孔二氧化硅纳米颗粒分散于PBS缓冲液中,并加入荧光素,常温超声分散均匀后搅拌24小时,离心分离,得到装载荧光素的介孔二氧化硅纳米颗粒。
2、将量子点和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐分散于PBS缓冲液中,常温搅拌20~30分钟,然后加入装载荧光素的介孔二氧化硅纳米颗粒,常温孵化3~4小时,用PBS缓冲液离心洗涤,得到双荧光的介孔二氧化硅纳米颗粒。
3、将步骤2得到的双荧光的介孔二氧化硅纳米颗粒分散于去离子水中,并加入十六烷基三甲基溴化铵,常温搅拌20~30分钟,用甲醇离心洗涤,所得沉淀超声分散于甲醇中,并加入Zn(NO3)2·6H2O和二甲基咪唑,50℃下静置2~3小时,用甲醇离心洗涤,得到双荧光的核壳结构介孔二氧化硅@ZIF-8复合纳米粒子。
4、将双荧光的核壳结构介孔二氧化硅@ZIF-8复合纳米粒子分散于PBS缓冲液中,然后加入酶,在3~5℃下孵育12~16小时,用PBS缓冲液离心洗涤,得到固载酶的核壳结构复合纳米粒子,即用于比率荧光检测的固定化酶反应器。
上述步骤3中,所述Zn(NO3)2·6H2O和二甲基咪唑摩尔比为1:1。
上述的PBS缓冲液的pH=7.4。
本发明在表面胺基化的介孔二氧化硅纳米颗粒的孔道内装载荧光素后,在其表面修饰量子点,得到双荧光的介孔二氧化硅纳米颗粒,即建立比率荧光传感器的信号显示单元;然后在该材料表面沉积包覆ZIF-8过渡层,形成核壳结构的复合纳米粒子,所得核壳结构的复合纳米粒子具有尺寸选择性、抗干扰性能、化学和热稳定性、可分散性,这不仅保护了核心免受腐蚀,而且大大减少了大型分子的背景干扰,更重要的是,ZIF-8外壳对大多数酶都有很高的亲和力;最后以该核壳结构复合纳米粒子为载体,通过配位键将酶紧密地固定在ZIF-8外壳表面,从而得到固定化酶反应器。
本发明固定化酶反应器可根据固载的酶不同,基于比率荧光检测不同的酶解底物。
相对于现有技术,本发明具有以下有益效果:
1、本发明有效的将荧光素用量子点封装在介孔二氧化硅孔隙中,形成了比率的荧光体系,然后用ZIF-8作为过渡层将比率荧光体系保护在其中,并且其表面的未饱和Zn2+可以有效的修饰生物酶,形成固定化酶反应器。
2、本发明固定化酶反应器合成方法简单,基于比率荧光检测实际样品时不需要加入额外试剂,具有灵敏度高、准确性好且特异性好等优点。
附图说明
图1是MSNs的TEM图。
图2是AF-MSNs的TEM图。
图3是AF-MSN-QDs的TEM图。
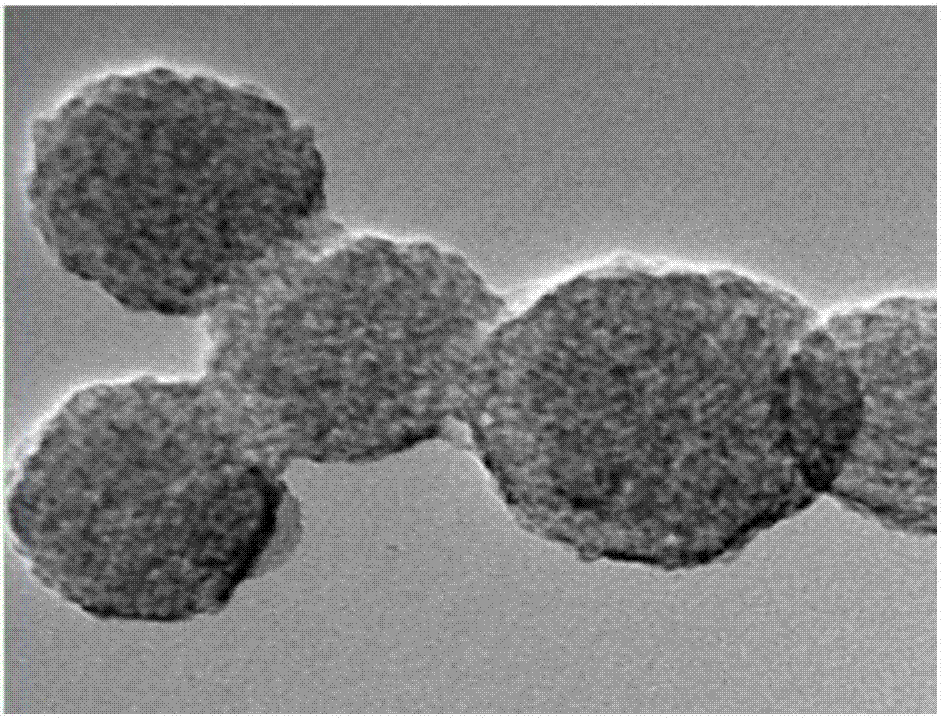
图4是AF-MSN-QD@ZIF-8的TEM图。
图5是MSNs(A)、AF-MSNs(B)和AF-MSN-QDs(C)的红外光谱曲线图。
图6是AF-MSN-QD@ZIF-8的EDX光谱。
图7是AF(a)、QDs(b)以及AF-MSN-QD@ZIF-8(c)的荧光发射光谱图。
图8是采用AF-MSN-QD@ZIF-8-ChOx检测不同浓度胆固醇的荧光光谱图。
图9是胆固醇浓度与I520/I618的线性关系图。
图10是采用AF-MSN-QD@ZIF-8-ChOx分析血清样本的结果图。
具体实施方式
下面结合附图和实施例对本发明进一步详细说明,但本发明的保护范围不仅限于这些实施例。
实施例1
制备固载胆固醇氧化酶的核壳结构复合纳米粒子
1、将100mg表面胺基化的介孔二氧化硅纳米颗粒(MSNs)分散于5mL 10mmol/L pH=7.4的PBS缓冲液中,加入1mL 0.5mmol/L 5-氨基荧光素(AF)的PBS缓冲液(pH值7.4,10mmol/L),常温超声分散均匀,搅拌24小时,8000转/分钟离心分离,得到封装5-氨基荧光素的介孔二氧化硅纳米颗粒(记作AF-MSNs)。
2、将5mg CdTe QDs(根据文献“Huang,K.;Xu,K.;Zhu,W.;Yang,L.;Hou,X.;Zheng,C.Anal.Chem.2016,88,789–795”中公开的方法制备而成)和40mg 1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)分散于1.5mL 10mmol/L pH=7.4的PBS缓冲液中,在常温下搅拌30分钟以激活CdTe QDs。然后将50mg AF-MSNs溶解于4mL 10mmol/L pH=7.4的PBS缓冲液后加入到激活后的CdTe QDs中,并在常温下孵化3小时,用10mmol/L pH=7.4的PBS缓冲液在8000转/分钟下离心洗涤5次,每次10分钟,去除自由的CdTe QDs,得到双荧光的介孔二氧化硅纳米颗粒(记作AF-MSN-QDs)。
3、将步骤2得到的AF-MSN-QDs分散于5mL去离子水中,加入300μL 0.01mol/L十六烷基三甲基溴化铵(CTAB)水溶液,常温搅拌30分钟,8000转/分钟离心分离,沉淀用甲醇离心洗涤3次,以去除多余的CTAB,然后将沉淀超声分散于30mL甲醇中,并加入30mL 25mmol/LZn(NO3)2·6H2O的甲醇溶液和30mL 25mmol/L二甲基咪唑的甲醇溶液,静置3小时,用甲醇在8000转/分钟下离心洗涤,得到双荧光的核壳结构介孔二氧化硅@ZIF-8复合纳米粒子(记作AF-MSN-QD@ZIF-8)。
4、将20mg AF-MSN-QD@ZIF-8分散于10mL 10mmol/L pH=7.4的PBS缓冲液中,然后加入2mL 100U/mL胆固醇氧化酶(ChOx)的PBS缓冲液,在4℃下孵育12小时,用10mmol/L pH=7.4的PBS缓冲液在转/分钟下离心洗涤3次,得到固载ChOx的核壳结构复合纳米粒子(记作AF-MSN-QD@ZIF-8-ChOx)。
由图1可见,MSNs的平均直径约为70nm、平均孔径约为2.7nm,这空隙足够大,足以装载荧光素;与MSNs相比,AF-MSNs与MSNs的形态有明显的不同,这表明MSNs内部的染料成功封装(见图2);与此相反,在MSNs的外部,由QDs覆盖的MSNs的TEM图像显示了直径为6nm的暗点,这表明在MSNs的表面聚集了QDs(见图3),且合成的AF-MSN-QDs中CdTe QDs是由多个QDs组成的,几乎与原始的QDs具有相同的形态学特征。AF-MSN-QD@ZIF-8的核心是AF-MSN-QDs,ZIF-8外壳的厚度约为31nm,证明了ZIF-8外壳成功的包装在AF-MSN-QDs表面(见图4)。ZIF-8外壳不仅能保护核心免受腐蚀,而且还能极大地减少大型分子的背景干扰,并且进一步提供了一个简单的酶固定的平台。对比图5中的红外光谱曲线A和B,AF-MSNs在1395~1440cm-1和1470cm-1处出现了C=C拉伸振动吸收峰,说明在MSNs多孔结构中成功地封装了AF;对比图5中的红外光谱曲线B和C,AF-MSN-QDs在1562cm-1处出现了CO-NH振动吸收峰,表明在AF-MSNs的表面上成功地接合了QDs。由图6和表1可见,AF-MSN-QDs包覆ZIF-8后有6.62At %的Zn2+存在。图7显示,AF和QDs分别具有520nm和618nm的特征峰值,而AF-MSN-QD@ZIF-8则在520nm和618nm中表现出两个特征峰值。
表1
采用上述实施例1制备的AF-MSN-QD@ZIF-8-ChOx检测胆固醇,具体方法如下:
将2.5mg AF-MSN-QD@ZIF-8-ChOx分散于5mL10mmol/L pH=7.4的PBS缓冲液中,配制成0.5mg/mL AF-MSN-QD@ZIF-8-ChOx溶液;将胆固醇分散于5mL10mmol/L pH=7.4的PBS缓冲液中,分别配制成浓度为0、2、4、6、8、10、20、40、60、80、100μg/mL的胆固醇溶液。取100μL不同浓度的胆固醇溶液,分别与100μL0.5mg/mL AF-MSN-QD@ZIF-8-ChOx溶液混合,在37℃下孵育30min后,采用PE LS55荧光分光光度计(荧光条件:激发波长为440nm、发射光谱的范围为480~700nm,激发和发射的狭缝宽度分别为10nm、10nm)检测不同浓度胆固醇对应体系的荧光光谱和在发射波长为520nm和618nm处不同浓度胆固醇对应体系的荧光强度I520和I618,结果见图8,并绘制荧光比率值I520/I618随胆固醇浓度变化的标准曲线,见图9。
由图8可见,胆固醇浓度从0到100μg/mL范围内,对应体系在520nm处的荧光强度I520基本不变,而618nm处的荧光强度I618随着胆固醇浓度的增加逐渐减少。这是由于胆固醇与氧气在ChOx催化作用下反应生成H2O2,生成的H2O2与AF-MSN-QDs表面的QDs反应,从而猝灭QDs的荧光,导致荧光强度显著下降。胆固醇的浓度越大,618nm处的荧光强度下降越多。由图9可见,胆固醇浓度在0~10.00μg/mL以及10~100μg/mL时,I520/I618与胆固醇浓度分别呈线性关系,其中胆固醇浓度为0~10.00μg/mL范围内的线性方程为y=0.0123x+0.91837,相关系数是0.99417;胆固醇浓度为10~100.00μg/mL范围内的线性方程为y=0.00255x+1.0258,相关系数是0.99292,式中y为I520/I618,x为胆固醇浓度。由相关系数可见,荧光比率值I520/I618与胆固醇浓度的线性关系很好。经测试,胆固醇的检出限为0.923μg/mL(3σ/斜率,σ即空白样本的标准偏差)。
发明人按照上述基于比率荧光检测胆固醇的方法对实际样品进行了检测,具体方法如下:
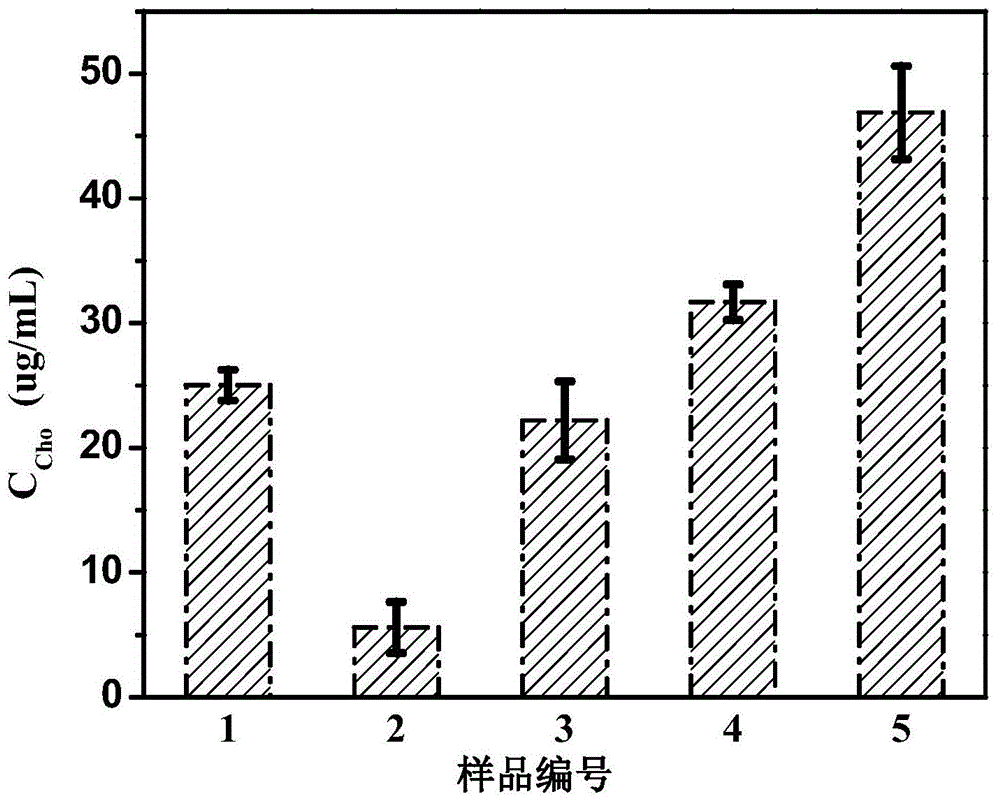
采集第四军医大学(中国)健康志愿者的血液样本,加入到0.5mL含有3.8wt%的柠檬酸钠水溶液的PS管中,10000转/分钟离心10分钟,取上清液获得血清。取100μL样品与100μL 0.5mg/mL AF-MSN-QD@ZIF-8-ChOx溶液混合,在37℃下孵育30min后,采用PE LS55荧光分光光度计(荧光条件:激发波长为440nm、发射光谱的范围为480~700nm,激发和发射的狭缝宽度分别为10nm、10nm)检测对应体系的荧光强度,结果见图10。其中,1号样品是将胆固醇加入pH 7.4的PBS缓冲液中,配制的25μg/mL的胆固醇PBS溶液,2号样品是血清用pH 7.4的PBS缓冲液稀释200倍的溶液;3号样品是血清用pH 7.4的PBS缓冲液稀释50倍的溶液;4号样品是血清用pH7.4的PBS缓冲液稀释200倍后加入胆固醇,配制的25μg/mL的胆固醇溶液;5号样品是血清用pH 7.4的PBS缓冲液稀释50倍后加入胆固醇,配制的25μg/mL的胆固醇溶液。由图10可见,采用AF-MSN-QD@ZIF-8-ChOx成功实现了包含不同浓度胆固醇的真实人体血清样本的测试,RSD为3.0%~4.8%。





评论
全部评论
共{{commentCount}}条{{rs.Msg_Content}}